Causes biologiques du vieillissement
Introduction :
 On peut définir le vieillissement comme l’ensemble des mécanismes qui, au cours du temps, altèrent les fonctions d’un être, l’empêchent de maintenir son équilibre physiologique, et finalement entraînent sa mort. Chez l’homme comme chez la plupart des êtres vivants, c’est un processus complexe et progressif qui implique de nombreux facteurs biologiques. Ce processus naturel peut être amplifié par des événements extérieurs (pollution, alimentation, tabac…) tout au long de la vie.
On peut définir le vieillissement comme l’ensemble des mécanismes qui, au cours du temps, altèrent les fonctions d’un être, l’empêchent de maintenir son équilibre physiologique, et finalement entraînent sa mort. Chez l’homme comme chez la plupart des êtres vivants, c’est un processus complexe et progressif qui implique de nombreux facteurs biologiques. Ce processus naturel peut être amplifié par des événements extérieurs (pollution, alimentation, tabac…) tout au long de la vie.
Les scientifiques se sont particulièrement intéressés au vieillissement lors de ces 30 dernières années. En effet, grâce aux nouvelles avancées technologiques, il a été permis d’étudier les mécanismes du vieillissement plus en détail. Plusieurs études émettent différents postulats quant à l’origine du vieillissement, qui serait contrôlé par des facteurs génétiques et des processus biologiques inhérents aux hommes.
Il a alors été possible d’appréhender les causes du vieillissement en comprenant comment il agit sur les êtres vivants et les différents facteurs déterminant l’espérance de vie. Cela pourrait permettre de ralentir ce processus naturel et allonger notre espérance de vie.
Tout au long de cet article, nous avons examiné les principales causes biologiques du vieillissement ciblées par thérapies expérimentales contre le vieillissement : les lésions du génome, le raccourcissement des télomères, les facteurs épigénétiques, le dérèglement de la réponse protéique, le dysfonctionnement des mitochondries, le dérèglement de la détection de nutriments, la sénescence cellulaire, l’épuisement des cellules souches et l’inflammation chronique liée au vieillissement. Mais comment agissent ces différents processus sur les cellules et les tissus ? Et quelles sont les conséquences de ces altérations sur la longévité ?
Pour une version plus scientifique de cet article retrouvez : Les causes biologiques du vieillissement et de la limitation de la durée de vie ou l’excellente review du magazine Cell : The Hallmark of Aging
![]()
Lésions de l’ADN : une cause du vieillissement
Définition du génome : Le génome représente l’ensemble des informations génétiques d’un organisme. Ces informations sont principalement stockées dans le noyau de chacune de nos cellules. Le génome est le plan de fabrication de notre organisme, il contient toutes les informations qui permettent à nos cellules de fabriquer et de faire fonctionner notre organisme. Ces informations sont stockées sous forme d’ADN, et chaque fragment d’ADN représente une caractéristique précise d’un individu (gène). Le génome humain contient entre 25 000 et 30 000 gènes. L’ADN situé dans le noyau est enroulé autour de protéines appelées histones, cet ensemble ADN-Histone forme les chromosomes. Ces chromosomes jouent le rôle de support de l’information génétique et sont répliqués lors de chaque division cellulaire afin de transmettre l’information à la cellule fille créée.
 Tout au long de la vie, les cellules se divisent un grand nombre de fois, et des anomalies génétiques apparaissent, notamment chez les organismes âgés[1]. Ces mutations arrivent principalement lors de la réplication de l’ADN et peuvent toucher des gènes importants ou encore entraîner des problèmes de transcription. Une fois qu’il y a expression de ces gènes mutés, ils entraînent des dysfonctionnements cellulaires, pouvant entraîner des dérèglement dans l’ensemble du tissu, lorsqu’il n’y a pas activation des mécanismes de protection et de réparation tels que l’apoptose (mort cellulaire) ou la sénescence cellulaire (dégradation des fonctions de la cellule).
Tout au long de la vie, les cellules se divisent un grand nombre de fois, et des anomalies génétiques apparaissent, notamment chez les organismes âgés[1]. Ces mutations arrivent principalement lors de la réplication de l’ADN et peuvent toucher des gènes importants ou encore entraîner des problèmes de transcription. Une fois qu’il y a expression de ces gènes mutés, ils entraînent des dysfonctionnements cellulaires, pouvant entraîner des dérèglement dans l’ensemble du tissu, lorsqu’il n’y a pas activation des mécanismes de protection et de réparation tels que l’apoptose (mort cellulaire) ou la sénescence cellulaire (dégradation des fonctions de la cellule).
De récentes études ont montré que les systèmes de réparation de l’ADN pouvait être impliqués dans le vieillissement. En effet, un système de contrôle existe afin de réparer l’ADN endommagé au cours d’une réplication. Ces systèmes utilisent des protéines et des enzymes afin de réparer la cellule modifiée. Ces protéines, en plus de modifier l’ADN corrompu, ont d’autres impacts : consommation de NAD+ (voir : Définitions) ou des liens avec le fonctionnement des mitochondries[2]. Des études ont montré que ces protéines réparant l’ADN (PARP) sont présentes en plus grand nombre dans les organismes âgés[3]. Une sur-expression de ces protéines pourrait alors mener à l’épuisement des réserves de NAD+, qui est nécessaire à l’activation de nombreuses molécules NAD-dépendantes comme les sirtuines, et peut aussi induire la mort cellulaire, si les dégâts sur l’ADN sont trop importants[4]. Ainsi avec l’âge, le nombre de cellules mortes ou en sénescence augmente fortement, ce qui peut expliquer la dégradation des tissus et des organes.

D’autres systèmes de régulation du fonctionnement cellulaire peuvent avoir un effet négatif à long terme, tels que la protéine p53. Elle est responsable de la suppression des cellules cancérigènes et permet donc de préserver les organes, en évitant le développement de cancer. Mais lorsqu’il y a sur-expression de cette protéine, cela accélère le vieillissement et le nombre de cellules détruites devient trop important, il y a perte d’homogénéité dans les tissus [4][5].
Ces deux procédés, qui sont à l’origine bénéfiques pour le corps, deviennent délétères avec l’âge.
Une interprétation possible serait que les lésions de l’ADN peuvent croître exponentiellement dus aux mutations qui peuvent toucher des gènes indispensables au fonctionnement cellulaire ou du système de réparation de l’ADN. L’activation de PARP, qui protège l’organisme contre les dégâts de l’ADN dans les cellules, est aussi lié à l’épuisement des cellules en NAD+. Cette coenzyme est nécessaire à l’activation de tous les NAD-dépendants (sirtuines), cet appauvrissement provoque un mauvais fonctionnement des cellules.
![]()
Rétrécissement des télomères : lien avec l’espérance de vie et le vieillissement
Les chromosomes, situés dans le noyau, sont le support de l’information génétique. Leur extrémité, appelée télomère, est une région ne possédant pas d’information génétique. Des études ont montré que la longueur des télomères diminuait progressivement avec l’âge et que ce rétrécissement augmentait le risque de développement de maladies liées à l’âge (fibrose pulmonaire, dégénérescence des tissus…)[6][7][8].
Fonctionnement du rétrécissement des télomères
 Lors de son cycle cellulaire (ensemble des étapes qui constituent la vie d’une cellule), une cellule se divise et réplique son ADN afin de transférer l’information génétique à la nouvelle cellule créée. Lors de ce processus de réplication, systématiquement, il n’y a pas réplication d’une partie de l’extrémité du chromosome, le télomère. Ceci entraîne un rétrécissement progressif des télomères à chaque division cellulaire. Une enzyme appelée télomérase permet la synthèse d’ADN télomérique. Cette enzyme n’est pas présente dans tout l’organisme mais dans certaines cellules, telles que les cellules embryonnaires ou les cellules souches. Elle permet la réplication entière du télomère et donc son maintien au cours des divisions cellulaires. Sa présence dans les cellules cancéreuses explique leur immortalité : elles peuvent se diviser à l’infini, sans risque de dégradation et de mort cellulaire. Le fonctionnement de cette enzyme est donc très intéressant pour les scientifiques. Cependant le risque de sur-expression de cette enzyme est le développement de cellules cancéreuses qui sont définies comme étant des cellules immortelles.
Lors de son cycle cellulaire (ensemble des étapes qui constituent la vie d’une cellule), une cellule se divise et réplique son ADN afin de transférer l’information génétique à la nouvelle cellule créée. Lors de ce processus de réplication, systématiquement, il n’y a pas réplication d’une partie de l’extrémité du chromosome, le télomère. Ceci entraîne un rétrécissement progressif des télomères à chaque division cellulaire. Une enzyme appelée télomérase permet la synthèse d’ADN télomérique. Cette enzyme n’est pas présente dans tout l’organisme mais dans certaines cellules, telles que les cellules embryonnaires ou les cellules souches. Elle permet la réplication entière du télomère et donc son maintien au cours des divisions cellulaires. Sa présence dans les cellules cancéreuses explique leur immortalité : elles peuvent se diviser à l’infini, sans risque de dégradation et de mort cellulaire. Le fonctionnement de cette enzyme est donc très intéressant pour les scientifiques. Cependant le risque de sur-expression de cette enzyme est le développement de cellules cancéreuses qui sont définies comme étant des cellules immortelles.
Effet du rétrécissement des télomères sur le vieillissement
Les télomères ont un effet protecteur sur l’ADN. En effet, cette partie du chromosome ne possède pas d’information génétique. Au cours de la vie, ils sont grignotés à chaque réplication jusqu’à pratiquement disparaître et laisser l’ADN codant à nu. L’ADN n’est alors plus protégé lors de sa réplication et des informations essentielles risquent d’être perdues. Pour éviter le développement de ces cellules, il y a entrée en sénescence ou en apoptose.
Une étude réalisée à Harvard consistait à modifier génétiquement des souris faibles et âgées afin d’activer les gènes responsables de la production de télomérase. Un rajeunissement des souris a été observé, ainsi qu’une régénération des tissus abîmés[9].
Une autre étude a été faite sur des cellules de la peau : ces cellules en culture peuvent se diviser entre 40 et 60 fois durant leur vie avant d’entrer en sénescence. En les modifiant génétiquement afin d’activer la production de télomérase, ces mêmes cellules ont pu se diviser jusqu’à 300 fois.
Ces deux expériences montrent l’importance qu’ont les télomères dans l’espérance de vie d’une cellule. En revanche, accentuer la production de télomérase n’est pas une solution envisageable pour l’instant, de par son lien avec l’apparition de cancer.
Le rétrécissement des télomères peut être vu comme l’ “horloge biologique” de la cellule. Ce mécanisme est une limite à l’espérance de vie des cellules. C’est pourquoi il a une place très importante dans les recherches actuelles contre le vieillissement.
![]()
Les facteurs épigénétiques de vieillissement
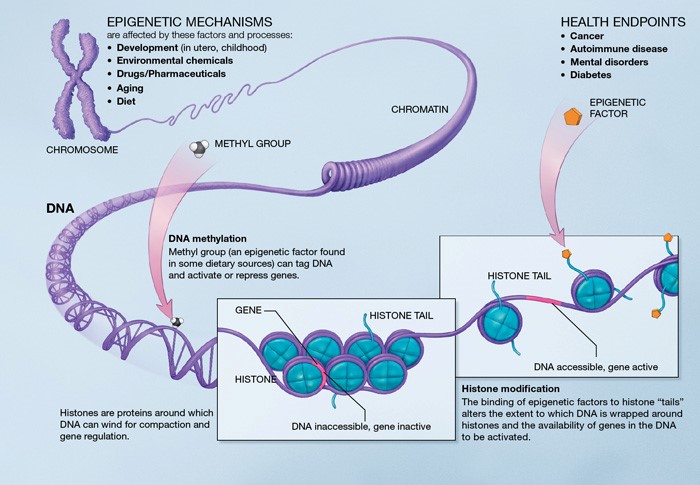
L’épigénétique est l’étude des mécanismes qui gèrent l’expression du patrimoine génétique. Si la génétique s’intéresse directement aux gènes, l’épigénétique s’intéresse à l’utilisation de ces gènes. Cette discipline met donc en évidence la variabilité de l’expression d’un gène (expression ou non) en fonction de son environnement. Cette variabilité s’observe au niveau des organes : chaque cellule dispose de la même information génétique, pourtant d’une cellule à une autres les fonctions peuvent être différentes. Cela représente bien les différences d’expression des gènes en fonction de leur environnement. Un bon exemple pour comprendre ce phénomène : les abeilles. Une larve pourra devenir une reine ou une ouvrière en fonction de la façon dont elle est nourrie. Il s’agit ici d’un phénomène épigénétique : une même information de départ, pour un résultat différent. Ce domaine est très intéressant pour comprendre le vieillissement car cela décrit l’évolution de l’activité cellulaire au cours du temps à travers l’expression des gènes.
Différents facteurs pouvant changer la lecture d’un gène :
La méthylation d’un gène : La méthylation est un phénomène épigénétique dans lequel certains gènes peuvent être modifiés par l’addition ou la suppression d’un groupe méthyle. Cela peut stimuler ou inhiber l’expression d’un gène ou accroître le risque de mutations. Les modifications épigénétiques liées à la méthylation augmentent avec l’âge, pouvant entraîner de graves problèmes (taux de cholestérol, risques cardio-vasculaires…)[9].
Remodelage de chromatine : La chromatine est la forme sous laquelle se présente l’ADN dans le noyau, elle permet l’empaquetage de l’ADN avec les protéines. Avec l’âge, la quantité de facteurs entraînant le remodelage de la chromatine diminue et cela affecte la stabilité des chromosomes[10]. En effet, des études ont montré que la régulation de chromatine était un facteur influençant la longueur des télomères. Cette altération épigénétique peut entraîner un vieillissement accéléré à travers le rétrécissement des télomères (voir la partie rétrécissement des télomères).

Modification d’histones : Les histones sont les protéines autour desquelles s’enroule l’ADN, elles sont les principaux constituants des chromosomes. Une modification des composants présents sur l’histone (groupe acétyle) peut avoir un effet important sur l’organisme et modifier l’expression d’un gène (ex : la suppression de groupes acétyles sur une histone chez les invertébrés peut augmenter leur espérance de vie[11]). Certaines hormones sont responsables d’ajouts ou de suppression de composants sur l’histone (sirtuines, NF-kB) modifiant donc la stabilité du génome [12]. La modification des histones a donc un effet sur l’espérance de vie en modifiant l’expression de certains gènes.
L’étude de l’altération épigénétique est au cœur du processus de vieillissement. Cela décrit les changements dans l’activité cellulaire au cours du temps. La méthylation des gènes et la modification des histones sont responsables de changement dans l’expression du génome. Ces altérations sont associées à des maladies liées à l’âge comme l’athérosclérose, la démence et le cancer.
![]()
Détérioration de la réponse protéique : une cause de vieillissement
Protéine : Les protéines sont des acteurs majeurs dans de nombreux mécanismes cellulaires. Elles sont les « briques » de notre corps et structurent nos cellules. En tant qu’anticorps ou hormones, elles ont aussi un rôle actif au sein du corps, en tant que messagères de nos cellules.
Acide aminé : Ce sont les constituants des protéines. Chaque acide aminé confère à la protéine des propriétés chimiques spécifiques et leur ordre d’assemblage lui donne à la protéine une fonction bien précise.
Repliement des protéines
Le fonctionnement des protéines se fait principalement grâce à leur forme. Cette forme permet à la protéine d’être reconnue et de pouvoir assurer sa fonction. Le repliement de la protéine lui permet de prendre sa forme effective. Ce repliement des protéines est un processus physique grâce auquel une protéine va acquérir sa structure spatiale avec laquelle elle est fonctionnelle. Chaque protéine a une forme dépliée, il s’agit d’une chaîne linéaire d’acides aminés, qui n’est pas fonctionnelle. Elle prend sa forme grâce aux propriétés chimiques de chaque acide aminé, et cette forme est indispensable afin d’assurer sa fonction au sein de la cellule.
Des études ont montré que de nombreuses maladies liées à l’âge, en particulier les maladies neuro-dégénératives (Alzheimer, Parkinson…) seraient due à l’accumulation de protéines dépliées au sein des cellules, provoquant leur mauvais fonctionnement[13].
Protéines chaperonnes
Les protéines chaperonnes sont indispensables à l’assemblage, au transport et à la destruction des protéines. Elles ont donc un rôle clé dans le fonctionnement du corps [14]. Le vieillissement réduit leur activité et leur synthèse, cela crée donc des problèmes de gestion des protéines [15](accumulation de protéines défectueuses au sein des cellules, repliement de protéines dénaturées…). Deux causes probables du dysfonctionnement des protéines chaperonne sont le mauvais apport en ATP, nécessaire à leur fonctionnement, ou une modification de son « capteur » peut empêcher la protéine chaperonne d’identifier sa cible[16].
Afin d’empêcher l’accumulation de protéines dépliées ou mal repliées, il y a activation de voies de signalisation entre le noyau et les mitochondries, afin de détruire ces protéines défectueuses. Cette communication se dégrade lors du vieillissement (voir dysfonctionnement des mitochondries) ce qui entraîne une accumulation de protéines non-fonctionnelles au sein des cellules.
Le rôle essentiel des protéines dans notre organisme (messagères, anticorps, hormone…) fait de ce dysfonctionnement une cause principale du vieillissement. Les protéines chaperonnes et la communication entre noyau et mitochondries régissent le bon fonctionnement des protéines. Leur détérioration a donc un impact direct sur le vieillissement.
![]()
Dysfonctionnement des mitochondries et effet sur le vieillissement
Les mitochondries sont des organites (éléments constituant la cellule tels que le noyau, la mitochondrie, etc.). Elles sont présentes dans les cellules et leur rôle est de maintenir la respiration cellulaire et la création d’ATP, source d’énergie indispensable pour tous les mécanismes du corps humain. Elles sont considérées comme des centrales énergétiques des êtres vivants. Leur rôle est donc primordial et leur dysfonctionnement peut amener à la mort de la cellule.
Le mtADN
Les mitochondries sont les seuls organites à posséder leur propre ADN, le ADNmt.
Des études ont été faites sur l’évolution du fonctionnement des mitochondries à différents stades de la vie et leur dysfonctionnement semble être une marque inévitable du vieillissement. Des chercheurs ont démontré que le dysfonctionnement des mitochondries survenait alors qu’il n’y avait pas de modifications significatives sur l’ADNmt, cela suggère que le dysfonctionnement lié à l’âge de la mitochondrie n’est pas déclenché par la mutation d’ADNmt mais par un ou plusieurs autres phénomènes.
Stress oxydatif
Stess oxydatif : Le stress oxydatif correspond à une oxydation des différents constituants de nos cellules qui se caractérise généralement par un perte d’électrons. Les molécules responsables de cette oxydation sont les radicaux libres. Ils proviennent de l’oxygène contenu dans l’air que nous respirons.
Le stress oxydatif a été étudié comme cause possible du dysfonctionnement des mitochondries. En effet, on a longtemps lié le vieillissement à l’usure engendrée par ces espèces oxydantes (radicaux libres). Il semblerait que ce phénomène ait été mal compris. A l’inverse de cette théorie, des études ont montré qu’augmenter le nombre d’antioxydants n’avait pas d’effet sur l’espérance de vie, alors qu’en augmentant le niveau de radicaux libres, il y avait également augmentation de la durée de vie[17][18]. Le rôle des radicaux libres n’est donc pas encore clair pour les scientifiques.
des radicaux libres n’est donc pas encore clair pour les scientifiques.
Communication entre noyau et mitochondrie
La communication entre le noyau et les mitochondries pourrait être une autre cause du vieillissement biologique [19]. Cette communication est nécessaire pour le bon fonctionnement de la mitochondrie, et donc essentielles pour la cellule. Ces communications se dégradent avec le vieillissement et la régulation des protéines nécessaires à cette communication diminue, entraînant un problème de communication entre noyau et mitochondrie. C’est une cause possible de la détérioration des mitochondries, pouvant entraîner un vieillissement des tissus.
L’altération des mitochondries est un phénomène complexe, qui a été beaucoup étudié, au vu des nombreuses interactions de cet organite avec le reste de la cellule. Cette dégradation est possiblement induite par l’altération de la communication entre noyau et mitochondrie. Ce dysfonctionnement est une cause importante du vieillissement, du fait du rôle primordial des mitochondries dans nos cellules.
![]()
Sénescence cellulaire et vieillissement
 Une cellule sénescente est une cellule vieillissante dont les fonctions se dégradent, elle cesse de se diviser et son activité change ( ex : sécrétion de molécules pro-inflammatoires [20]). Les cellules sénescentes sont présentent à tous les stades de la vie. Cela peut être causé par une modification de l’ADN (voir : Lésions du génome), le développement de cellule tumorale, etc. Les cellules sénescentes s’accumulent avec l’âge dans certains tissus, provoquant une perte d’homogénéité[21].
Une cellule sénescente est une cellule vieillissante dont les fonctions se dégradent, elle cesse de se diviser et son activité change ( ex : sécrétion de molécules pro-inflammatoires [20]). Les cellules sénescentes sont présentent à tous les stades de la vie. Cela peut être causé par une modification de l’ADN (voir : Lésions du génome), le développement de cellule tumorale, etc. Les cellules sénescentes s’accumulent avec l’âge dans certains tissus, provoquant une perte d’homogénéité[21].
La sénescence arrête alors les mécanismes de développement cellulaire et ces cellules sont ensuite détruites (phagocytose), sous condition d’avoir d’un système immunitaire performant. Or, avec l’âge, le système immunitaire devient moins efficace, le nombre de cellules sénescentes augmentant aussi, cela entraîne une accumulation de cellule sénescente dans certains tissus.
L’entrée en sénescence des cellules est donc bénéfique pour l’organisme, lorsqu’il fonctionne correctement. Il le protège contre la prolifération de cellules cancéreuses, mais nécessite un système immunitaire efficace afin d’éliminer ces cellules sénescentes. Dans le cas contraire, il s’agit d’un processus qui accentue le vieillissement de l’organisme, dû au manque de renouvellement des cellules souches et d’un système immunitaire moins efficace. Aujourd’hui, une des principales pistes thérapeutiques pour contrer ce problème est l’utilisation de médicaments sénolytiques, dont les essais sont encore en cours.
![]()
Épuisement des cellules souches : une cause du vieillissement
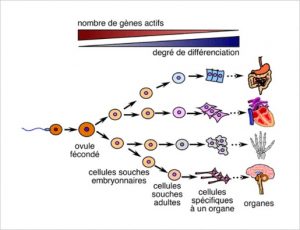
Cellule souche : Les cellules souches sont des cellules indifférenciées capables de se développer en cellules spécialisées grâce à la « différenciation cellulaire ». Ce mécanisme leur permet d’acquérir les caractéristiques propres à un type cellulaire. Cependant, il existe des catégories de cellules souches, de telle sorte que les cellules souches d’un humain adulte ne peuvent pas aboutir sur n’importe quel type de cellule différenciée. Par exemple, les globules rouges et les lymphocytes T ou B viennent à la base des même cellules indifférenciées, les cellules souches hématopoïétiques, mais ces dernières ne peuvent pas donner de cellules musculaires ou neuronales, etc. Certains organes possèdent des cellules souches déjà spécialisées, on parle des cellules souches unipotentes. C’est le cas de la peau, le foie, les muqueuses intestinales qui ont un renouvellement de cellules très rapide.
Épuisement des cellules souches : le lien avec la longévité
Les cellules souches permettent le renouvellement des cellules d’un organe. Elles sont stockées dans l’organisme et sont utilisées lorsqu’un renouvellement cellulaire est nécessaire. Cela est, par exemple, le cas des cellules en fin de vie qui doivent être remplacées. Un exemple : la durée de vie moyenne d’un globule rouge est de 120 jours. Cela est également possible lorsqu’un organe se développe et a un besoin supplémentaire en cellules, tel qu’un utérus qui grossit durant la grossesse. Cependant, certains organes ne renferment pas de cellule souche et ne peuvent donc pas se renouveler en cas de lésions, comme les cellules du cœur ou du pancréas.
Avec le vieillissement, on observe que les tissus ont de plus en plus de mal à se régénérer. Cela est dû au ralentissement des divisions cellulaires et au manque de remplacement des cellules souches. Ce comportement peut être expliqué par la sur-expression de protéines modifiant le cycle cellulaire ou l’accumulation de mutations sur l’ADN des cellules souches.[22][23]
Ces phénomènes augmentent donc le nombre de cellules sénescentes présentes dans un tissu, pouvant entraîner des désordres dans les organes touchés. Si on reprend l’exemple des cellules souches hématopoïétiques, un épuisement de ces cellules souches peut entraîner une immunodéficience, par un manque en lymphocytes B et T. Il en serait de même au niveau des muscles, du cerveau, des os… En plus d’un ralentissement de production des cellules souches, des mutations de leur ADN peuvent apparaître, pouvant déclencher la mort cellulaire chez certaines cellules, ou au contraire modifier leur information génétique tout en augmentant leur vitesse de réplication ou leur résistance (cellules précancéreuses).
En empêchant le renouvellement cellulaire et en entraînant la dégradation des organes, l’épuisement des cellules souches est une des principales causes de vieillissement. La compréhension des mécanismes de fonctionnement des cellules souches est ainsi déterminante pour l’avenir de la médecine régénérative.
![]()
Détection de nutriments : la restriction calorique pour prolonger la durée de vie
En fonction des quantités apportées par l’alimentation, les voies de signalisation impliquées dans la détection des nutriments ont une influence sur le comportement, le métabolisme, la croissance, le développement et la longévité cellulaire. Par exemple, la voie de signalisation qui permet la détection du glucose a également une influence sur la longévité. En effet, des chercheurs qui ont réussi à diminuer la voie de détection du glucose ont observé une augmentation de la durée de vie chez des vers, des mouches et des souris. Cependant le paradoxe reste entier, car si une importante baisse constitutive de la détection de glucose augmente la durée de vie, lorsque cette voie de signalisation est légèrement diminuée, cela est communément assimilé à un phénotype du vieillissement.
 D’autre part, dans le cadre d’un fonctionnement normal, un affaiblissement de la voie de détection de glucose est assimilé à un mécanisme de protection face aux dérèglements de l’organisme. En effet, une diminution de cette voie de détection entraîne un ralentissement du métabolisme et de la croissance cellulaire, et ainsi empêche le développement des dérèglements du système. Le dysfonctionnement des mécanismes de détection des nutriments peut alors être interprété comme étant un mécanisme de protection et de survie, qui se dégrade avec l’âge.
D’autre part, dans le cadre d’un fonctionnement normal, un affaiblissement de la voie de détection de glucose est assimilé à un mécanisme de protection face aux dérèglements de l’organisme. En effet, une diminution de cette voie de détection entraîne un ralentissement du métabolisme et de la croissance cellulaire, et ainsi empêche le développement des dérèglements du système. Le dysfonctionnement des mécanismes de détection des nutriments peut alors être interprété comme étant un mécanisme de protection et de survie, qui se dégrade avec l’âge.
La détection de nutriments semble alors avoir une influence sur le vieillissement et la durée de vie. Des études nutritionnelles pourraient alors apporter, non pas des informations sur le vieillissement, mais des indications sur la longévité [24].

Approche systémique : L’inflammation chronique liée au vieillissement
D’après plusieurs études, il serait possible de faire varier l’ensemble de l’organisme en faisant modifiant un paramètre en particulier. Des chercheurs ont démontré qu’en ciblant un tissu, il est possible d’avoir des conséquences bénéfiques sur les tissus voisins et ainsi prolonger la durée de vie. En conséquence, plusieurs études ont été menées afin de déterminer l’impact exact des facteurs systémiques lors du vieillissement des tissus et des organes.
Le cas de l’inflammation chronique
L’inflammation peut être définie comme étant un ensemble de réactions de réponse du corps face à des agressions variées : douleurs, rougeurs, chaleur, gonflements avec perturbation des fonctions cellulaires. Tout comme la douleur, l’hémostase (arrêt des saignements) et l’immunité, l’inflammation est un mécanisme indispensable au maintien de l’intégrité du corps.
Les causes d’une inflammation sont nombreuses : les lésions des tissus, les cellules sénescentes sécrétant des molécules pro-inflammatoire (les cytokines), l’élimination des cellules endommagées ou des pathogènes, la mauvaise gestion de la mort cellulaire programmée, l’accumulation de protéines endommagées, etc. Tous ces phénomènes entraînent l’apparition d’une réaction inflammatoire de protection et de défense.
Chez les mammifères vieillissants, il a été observé des signes induisant le déclenchement des processus inflammatoires [26]. Les cytokines (médiateurs responsables de la communication entre les différents types cellulaires) jouent un rôle important dans la réaction inflammatoire. Cependant, sur le long terme, les réactions entraînées par ces messagers pourraient être à l’origine de la vulnérabilité des tissus, du développement des maladies liées à l’âge et donc du vieillissement accéléré [27][28].
De faibles réactions inflammatoires sont favorables à la réparation et à la régénération tissulaire, par activation du système immunitaire. Cependant, des réponses inflammatoires trop fortes peuvent avoir pour conséquences d’aggraver les lésions et de causer d’autres dommages. Cela confirme bien qu’un mécanisme ciblant un organe ou un tissu peut avoir une influence sur le vieillissement de l’ensemble de l’organisme. Une nouvelle fois, le processus inflammatoire est un mécanisme de défense naturel de l’organisme qui devient nocif avec le temps et qui est lié au vieillissement.

Conclusion
9 causes du vieillissement biologique ont été présentées tout au long de cet article. Ces différentes causes sont potentiellement responsables de l’altération des fonctions de l’organisme. Certaines sont à l’origine des mécanismes bénéfiques mais qui deviennent délétères, avec l’âge. C’est le cas de la sénescence cellulaire ou encore des systèmes de réparation de l’ADN. Ces mécanismes empêchent le développement de cancer, mais lorsque leur activité devient trop importante ou se dérègle, ils accélèrent la dégénérescence de l’organisme .
Les autres causes étudiées sont principalement des mécanismes qui se dégradent progressivement au cours du temps (dysfonctionnement des mitochondries, rétrécissement des télomères …). Leur compréhension est nécessaire si nous voulons un jour les maîtriser et retarder leurs dérèglements, afin de potentiellement ralentir le vieillissement et donc rallonger la longévité humaine.

![]()
Définition
Génome : Le génome représente l’ensemble des informations génétiques d’un individu ou d’une espèce. Ces informations sont principalement stockées dans le noyau de chacune de nos cellules, elles contiennent toutes les caractéristiques internes et externes de notre organisme. Ces informations sont stockées sous forme d’ADN, chaque fragment d’ADN représente une caractéristique précise d’un individu (gène). Le génome humain contient entre 25 000 et 30 000 gènes. L’ADN situé dans le noyau est enroulé autour de protéines appelées histones, cet ensemble ADN + histone forme des chromosomes. Ces chromosomes sont donc le support de notre information génétique et sont répliqués lors de chaque division cellulaire afin de transmettre l’information à la cellule fille créée.
Mitochondrie : Les mitochondries sont des organites présentent dans les cellules, leur rôle est de maintenir la respiration cellulaire et la création d’ATP, source d’énergie indispensable pour tous les mécanismes du corps humain. Elles sont considérées comme des centrales énergétiques des êtres vivants.
Protéine : Les protéines sont des acteurs majeurs dans de nombreux mécanismes cellulaires. Elles sont les « briques » de notre corps en jouant un rôle de structure de nos cellules. Elles ont aussi un rôle actif au sein du corps, en tant qu’anticorps ou hormones, elles sont les messagères de nos cellules.
Acide aminé : Considéré comme les briques du vivant, ils sont les constituants des protéines. Chaque acide aminé confère à la protéine des propriétés chimiques spécifiques, et l’ordre d’assemblage lui donne une fonction bien précise.
Anticorps : Protéine utilisée par le système immunitaire afin de détecter et neutraliser les agents pathogènes.
Hormone : Substance chimique agissant par voie sanguine, elle transmet une information sous forme chimique qui sera décodée par des récepteurs.
Cellule souche : Les cellules souches sont des cellules indifférenciées (n’appartenant pas à un organe en particulier) capables d’engendrer des cellules spécialisées grâce à la différenciation cellulaire. Ce mécanisme leur permet d’acquérir les caractéristiques propres à un type de cellule. Les cellules souches d’un humain adulte ne peuvent pas aboutir sur n’importe quel type de cellule (ex : les globules rouges, les lymphocytes T ou B, viennent à la base des même cellules indifférenciées : les cellules hématopoïétiques, mais ces dernières ne peuvent pas donner de cellules musculaires, neuronales…). Certains organes possèdent des cellules souches déjà spécialisées (cellules souches unipotentes) comme la peau, le foie, les muqueuses intestinales, leur permettant un renouvellement des cellules très rapide.
NAD : Le nicotinamide adénine dinucléotide est une coenzyme présente dans toutes les cellules vivantes. Elle intervient dans de nombreux mécanismes comme la synthèse de l’ATP, le fonctionnement des mitochondries… La réserve de NAD diminue avec l’âge, affectant les mécanismes dans lesquels cette coenzyme jouait un rôle.
Sirtuines : Les sirtuines sont une classe d’enzymes NAD-dépendantes impliquées dans le processus de vieillissement. Elles ont un rôle crucial dans le contrôle de la longévité.
ATP : L’adénosine triphosphate ou ATP est une molécule présente dans tous les être vivants. Elle fournit l’énergie nécessaire aux réactions chimiques du métabolisme, à la locomotion, à la division cellulaire…
![]()
Hadrien Vielle

Author
Auteur
Hadrien is an engineer and was trained in biology, physics and bio-engineering at the École Polytechnique féminine in Paris.
More about the Long Long Life team
Hadrien est aujourd’hui ingénieur polyvalent après une formation en biologie, physique et bio-ingénierie à l’École Polytechnique féminine.
En savoir plus sur l’équipe de Long Long Life
Katidja Allaoui

Author
Auteure
Katidja studied biology and health engineering at the school of engineering of Angers.
More about the Long Long Life team
Katidja a étudié l’ingénierie de la biologie et de la santé à l’école d’ingénieurs de l’université d’Angers.
En savoir plus sur l’équipe de Long Long Life
Références
[1] Alexey A. Moskalev et al., “The Role of DNA Damage and Repair in Aging through the Prism of Koch-like Criteria,” Ageing Research Reviews 12, no. 2 (March 2013): 661–84, doi:10.1016/j.arr.2012.02.001.
[2] Péter Bai and Carles Cantó, “The Role of PARP-1 and PARP-2 Enzymes in Metabolic Regulation and Disease,” Cell Metabolism 16, no. 3 (September 5, 2012): 290–95, doi:10.1016/j.cmet.2012.06.016.
[2] Nady Braidy et al., “Age Related Changes in NAD+ Metabolism Oxidative Stress and Sirt1 Activity in Wistar Rats,” PLOS ONE 6, no. 4 (avr 2011): e19194, doi:10.1371/journal.pone.0019194.
[3] Weihai Ying et al., “NAD+ as a Metabolic Link between DNA Damage and Cell Death,” Journal of Neuroscience Research 79, no. 1–2 (January 1, 2005): 216–23, doi:10.1002/jnr.20289.
[4] Judith Campisi, “Senescent Cells, Tumor Suppression, and Organismal Aging: Good Citizens, Bad Neighbors,” Cell 120, no. 4 (February 25, 2005): 513–22, doi:10.1016/j.cell.2005.02.003.
[5] Braidy et al., “Age Related Changes in NAD+ Metabolism Oxidative Stress and Sirt1 Activity in Wistar Rats.”
[6] Elizabeth H. Blackburn, Carol W. Greider, and Jack W. Szostak, “Telomeres and Telomerase: The Path from Maize, Tetrahymena and Yeast to Human Cancer and Aging,” Nature Medicine 12, no. 10 (October 2006): 1133–38, doi:10.1038/nm1006-1133.
[7] Jerry W. Shay and Woodring E. Wright, “Senescence and Immortalization: Role of Telomeres and Telomerase,” Carcinogenesis 26, no. 5 (May 1, 2005): 867–74, doi:10.1093/carcin/bgh296.
[8] Mary Armanios and Elizabeth H. Blackburn, “The Telomere Syndromes,” Nature Reviews. Genetics 13, no. 10 (October 2012): 693–704, doi:10.1038/nrg3246.
[9] “Partial Reversal of Aging Achieved in Mice,” Harvard Gazette, accessed September 2, 2016, http://news.harvard.edu/gazette/story/2010/11/partial-reversal-of-aging-achieved-in-mice/.
[9] S. Sayols-Baixeras et al., “Identification and Validation of Seven New Loci Showing Differential DNA Methylation Related to Serum Lipid Profile: An Epigenome-Wide Approach. The REGICOR Study,” Human Molecular Genetics, September 15, 2016, doi:10.1093/hmg/ddw285.
[10] Gianluca Pegoraro et al., “Aging-Related Chromatin Defects via Loss of the NURD Complex,” Nature Cell Biology 11, no. 10 (October 2009): 1261–67, doi:10.1038/ncb1971.
[11] Chunyu Jin et al., “Histone Demethylase UTX-1 Regulates C. Elegans Life Span by Targeting the insulin/IGF-1 Signaling Pathway,” Cell Metabolism 14, no. 2 (August 3, 2011): 161–72, doi:10.1016/j.cmet.2011.07.001.
[12] Ibid.
[13] Susmita Kaushik and Ana Maria Cuervo, “Proteostasis and Aging,” Nature Medicine 21, no. 12 (December 2015): 1406–15, doi:10.1038/nm.4001.
[14] D. E. Feldman and J. Frydman, “Protein Folding in Vivo: The Importance of Molecular Chaperones,” Current Opinion in Structural Biology 10, no. 1 (February 2000): 26–33.
[15] Stuart K. Calderwood, Ayesha Murshid, and Thomas Prince, “The Shock of Aging: Molecular Chaperones and the Heat Shock Response in Longevity and Aging – A Mini-Review,” Gerontology 55, no. 5 (September 2009): 550–58, doi:10.1159/000225957.
[16] “Protein Modification and Maintenance Systems as Biomarkers of Ageing,” n.d.
[17] Ryan Doonan et al., “Against the Oxidative Damage Theory of Aging: Superoxide Dismutases Protect against Oxidative Stress but Have Little or No Effect on Life Span in Caenorhabditis Elegans,” Genes & Development 22, no. 23 (December 1, 2008): 3236–41, doi:10.1101/gad.504808.
[18] Ana Mesquita et al., “Caloric Restriction or Catalase Inactivation Extends Yeast Chronological Lifespan by Inducing H2O2 and Superoxide Dismutase Activity,” Proceedings of the National Academy of Sciences of the United States of America 107, no. 34 (August 24, 2010): 15123–28, doi:10.1073/pnas.1004432107.
[19] Michael T. Ryan and Nicholas J. Hoogenraad, “Mitochondrial-Nuclear Communications,” Annual Review of Biochemistry 76 (2007): 701–22, doi:10.1146/annurev.biochem.76.052305.091720.
[20] Tamara Tchkonia et al., “Cellular Senescence and the Senescent Secretory Phenotype: Therapeutic Opportunities,” Journal of Clinical Investigation 123, no. 3 (March 1, 2013): 966–72, doi:10.1172/JCI64098.
[21] Chunfang Wang et al., “DNA Damage Response and Cellular Senescence in Tissues of Aging Mice,” Aging Cell 8, no. 3 (June 2009): 311–23, doi:10.1111/j.1474-9726.2009.00481.x.
[22] Isabel Beerman et al., “Proliferation-Dependent Alterations of the DNA Methylation Landscape Underlie Hematopoietic Stem Cell Aging,” Cell Stem Cell 12, no. 4 (April 4, 2013): 413–25, doi:10.1016/j.stem.2013.01.017.
[23] Claudia E. Rübe et al., “Accumulation of DNA Damage in Hematopoietic Stem and Progenitor Cells during Human Aging,” PLoS ONE 6, no. 3 (March 7, 2011), doi:10.1371/journal.pone.0017487.
[24] McDonald, R. B., Ruhe, R. C. (2011). Aging and longevity: why knowing the difference is important to nutrition research. Nutrients, 3(3), 274-282.
[25] Villeda, S. A., Plambeck, K. E., Middeldorp, J., Castellano, J. M., Mosher, K. I., Luo, J., … Wabl, R. (2014). Young blood reverses age-related impairments in cognitive function and synaptic plasticity in mice. Nature medicine, 20(6), 659-663.
[26] Salminen, A., Kaarniranta, K., Kauppinen, A. (2012). Inflammaging: disturbed interplay between autophagy and inflammasomes. Aging (Albany NY) 4, 166175
[27] Morley, J.E., Baumgartner, R.N. (2004). Cytokine-Related Aging Process Journal of Gerontology: MEDICAL SCIENCES, Vol. 59A, No. 9, 924929
[28] Ferrucci, L., Harris, T.B., Guralnik, J.M., Tracy, R.P., Corti, M.C., Cohen, H.J., Penninx, B., Pahor, M., Wallace, R., Havlik, R.J., 1999. Serum IL-6 level and the development of disability in older persons. J. Am. Geriatr. Soc. 47, 639646.









![Vidéo – Les 9 causes du vieillissement, épisode 9, Inflammation [FINAL] – avec le Dr Guilhem Velvé Casquillas](http://www.longlonglife.org/wp-content/uploads/2019/05/Inflammation-Long-Long-Life-longévité-vieillissement-transhumisme-inflammaging-1-218x150.png)




