Le télomère : au cœur des processus de vieillissement
Qu’est-ce qu’un télomère ?
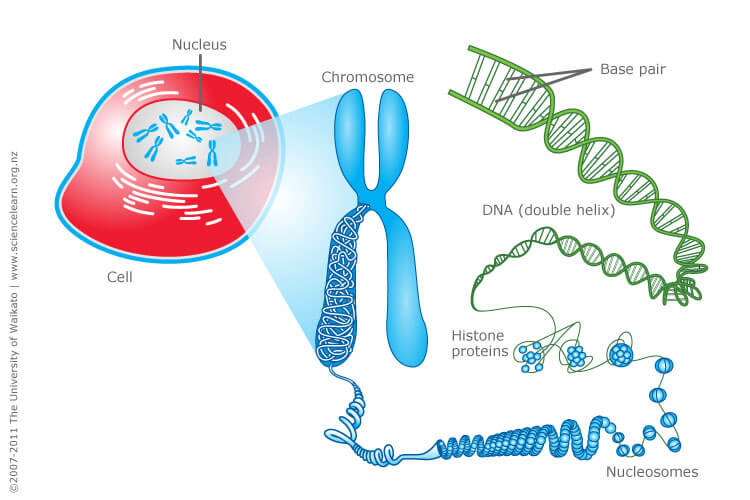
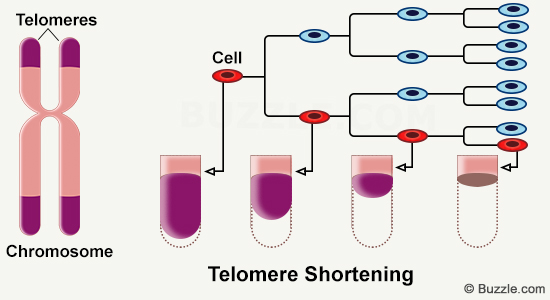
Dans les milliards de cellules qui composent notre corps, l’ADN est présent dans le noyau sous forme de chromosomes. Sur ces chromosomes, il existe des petites structures, appelées télomères, qui se raccourcissent progressivement et dont la longueur pourrait être liée à l’âge.
Les télomères sont des complexes de ribonucléoprotéines présents aux extrémités des chromosomes. Ils correspondent à des répétitions en tandem de séquences nucléotidiques (TTAGG) qui diminuent à chaque réplication cellulaire. Tout au long de la vie, les cellules se multiplient et accumulent des cycles de division et de réplication, afin de renouveler les cellules et tissus endommagés. Dans un organisme âgé, on observe un raccourcissement de la longueur des télomères [1]. A travers cet article, nous allons nous intéresser au fonctionnement de ces télomères et à l’impact de leur raccourcissement sur l’ensemble de l’organisme.
Fonctionnement du télomère au cours du vieillissement
Le raccourcissement des télomères est directement lié à la division cellulaire. En effet, en raison de l’incapacité des ADN polymérases à répliquer les extrémités des chromosomes linéaires, on observe à chaque cycle de réplication de l’ADN une perte de matériel génétique [1]. Le télomère ne contenant pas de séquences codantes, il n’y a pas de perte d’informations génomiques. Les télomères sont donc impliqués dans les processus de préservation de l’intégrité du génome et sont indispensables au bon fonctionnement cellulaire.
Dans le cas où aucun mécanisme n’entre en jeu pour régénérer les télomères, si le raccourcissement des télomères se produit à chaque cycle de réplication cellulaire, cela indique que la cellule ne peut pas vivre indéfiniment. La limite de Hayflick correspond au nombre maximal de divisions cellulaires que peut subir une cellule [2]. Elle permet de faire le lien entre la longueur du télomère et la durée de vie de la cellule.
Le télomère contrôle l’entrée en sénescence, une cause du vieillissement
Plus le télomère est court, plus il y a un risque de perdre de l’information génomique à la division suivant et d’induire des dysfonctionnements cellulaires majeurs. De ce fait, dans les cellules somatiques, lorsque les télomères atteignent la longueur « critique » de Hayflick, il y a activation de voies de réponse afin de réparer d’éventuels dommages subis par l’ADN. L’activation de ces voies entraîne un arrêt du cycle cellulaire, pouvant aller jusqu’à la sénescence ou l’apoptose de la cellule [3].
Au cours du processus de vieillissement, les cellules cumulent de multiples divisions mitotiques et il y a augmentation du risque de développement d’anomalies génétiques. Les télomères permettent d’éviter le développement de ces cellules en fin de vie. Leur mesure pourrait ainsi apporter des informations sur la vitesse de vieillissement et sur l’âge biologique.
Ainsi, on qualifie les télomères d’“horloges biologiques” de notre corps.

En plus du vieillissement, le télomère lutte contre les cellules tumorales
Les cellules tumorales sont des cellules somatiques ayant subi des dysfonctionnements lors de leur développement et dont la multiplication est très rapide. Leur prolifération entraîne un grand nombre de divisions cellulaires et donc un raccourcissement accéléré des télomères. Les télomères de ces cellules atteignent alors rapidement la limite de Hayflick et le même processus décrit précédemment entre en jeu. Un arrêt du cycle cellulaire est induit, provoquant l’entrée en sénescence de la cellule tumorale.
Le raccourcissement des télomères intervient donc dans les processus d’arrêt de la prolifération de cellules tumorales [3]. Dans le cadre d’un fonctionnement normal, il permet d’éliminer les tumeurs avant qu’elles ne deviennent malignes et se transforment en cancer.
Télomère et cellules souches : indispensables au cours du vieillissement
Cependant, il existe des mécanismes de maintien de la structure des télomères,  qui permettent de prolonger la durée de vie de certaines cellules. On retrouve, entre autres, la télomérase. C’est l’enzyme qui intervient pour synthétiser ces télomères [2].
qui permettent de prolonger la durée de vie de certaines cellules. On retrouve, entre autres, la télomérase. C’est l’enzyme qui intervient pour synthétiser ces télomères [2].
Cette télomérase n’est pas présente dans l’ensemble des cellules de l’organisme. On la retrouve active dans les cellule souches telles que les HSC, les NSC ou les ESC qui sont respectivement les cellules souches hématopoïétiques, neuronales et épidermiques. Ces cellules sont principalement impliquées dans les processus de renouvellement des tissus.
La présence de la télomérase dans ce type de cellules leur permet de perdurer dans le temps tout en restant fonctionnelles. L’accumulation de dérèglements liés aux télomères dans ce type de cellules pourrait alors provoquer la dégénérescence des tissus et des organes, une des caractéristiques principales des maladies associées à l’âge. Dans le cadre de la lutte contre le vieillissement, la connaissance des mécanismes biologiques de la télomérase semble indispensable.
Raccourcissement du télomère : pathologies associées au vieillissement
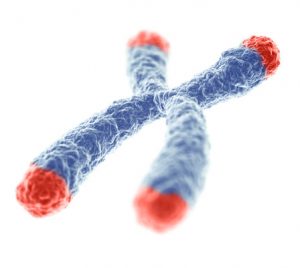 Des modifications sur la télomérase entraînent un raccourcissement accéléré des télomères. Cela a pour conséquence l’apparition de maladies telles que la dyskératose congénitale, pathologie qui touche les tissus nécessitant un renouvellement cellulaire rapide et constant, ou encore l’anémie aplasique, qui entraîne une diminution des globules du sang [2]. Ces maladies sont associées à un mauvais renouvellement des cellules et des tissus et reprennent des symptômes généralement retrouvés lors au vieillissement.
Des modifications sur la télomérase entraînent un raccourcissement accéléré des télomères. Cela a pour conséquence l’apparition de maladies telles que la dyskératose congénitale, pathologie qui touche les tissus nécessitant un renouvellement cellulaire rapide et constant, ou encore l’anémie aplasique, qui entraîne une diminution des globules du sang [2]. Ces maladies sont associées à un mauvais renouvellement des cellules et des tissus et reprennent des symptômes généralement retrouvés lors au vieillissement.
La longueur des télomères et la télomérase semblent fortement impliquées dans les processus de vieillissement. C’est pourquoi il serait intéressant d’inclure les télomères dans le développement d’une métrologie du vieillissement.
Tous les articles de notre dossier « Télomères et vieillissement » :
Les télomères : au cœur des processus de vieillissement
 Le raccourcissement des télomères est connu pour avoir une influence sur le vieillissement sans que cela ne soit pleinement explicité. Mais comment fonctionnent-ils ? Sur quels mécanismes biologiques agissent-ils ? Et pourquoi les qualifier d’ « horloges biologiques » de notre corps ?
Le raccourcissement des télomères est connu pour avoir une influence sur le vieillissement sans que cela ne soit pleinement explicité. Mais comment fonctionnent-ils ? Sur quels mécanismes biologiques agissent-ils ? Et pourquoi les qualifier d’ « horloges biologiques » de notre corps ?
Partie 1 : Causes et effets du raccourcissement des télomères au cours du vieillissement
 La vitesse de raccourcissement des télomères et le vieillissement varient d’un individu à l’autre, sans que cela ne soit encore pleinement clarifié. En effet, les causes qui pourraient expliquer les différences de longueur de télomères sont très variées.
La vitesse de raccourcissement des télomères et le vieillissement varient d’un individu à l’autre, sans que cela ne soit encore pleinement clarifié. En effet, les causes qui pourraient expliquer les différences de longueur de télomères sont très variées.
Partie 2 : L’influence de la télomérase sur les télomères et le vieillissement
 La longueur des télomères et la télomérase semblent être des facteurs clés du processus de vieillissement. De nombreuses études sur les maladies dues à des mutations des composants de la télomérase ont démontré que cela entraîne un mauvais renouvellement des cellules, soit l’un des phénotypes liés à l’âge.
La longueur des télomères et la télomérase semblent être des facteurs clés du processus de vieillissement. De nombreuses études sur les maladies dues à des mutations des composants de la télomérase ont démontré que cela entraîne un mauvais renouvellement des cellules, soit l’un des phénotypes liés à l’âge.
 L’expression de la télomérase est diminuée quelques semaines après la naissance dans la majorité des tissus adultes, à l’exception de certains types cellulaires, telles que les cellules souches. On peut alors se demander s’il existe un lien entre la diminution du stock de cellules souches avec l’âge, le fonctionnement de la télomérase et la longueur des télomères.
L’expression de la télomérase est diminuée quelques semaines après la naissance dans la majorité des tissus adultes, à l’exception de certains types cellulaires, telles que les cellules souches. On peut alors se demander s’il existe un lien entre la diminution du stock de cellules souches avec l’âge, le fonctionnement de la télomérase et la longueur des télomères.
Partie 4 : Vers une métrologie du vieillissement à partir du télomère
 Des méthodes de métrologie du vieillissement se basant sur la longueur des télomères ont été développée. Aujourd’hui, on en dénombre 5 principales, dont TAT ou STELA. Elles permettent toutes, à partir de la longueur des télomères, de fournir des indications précieuses sur l’avancement de l’âge physiologique ainsi que sur le vieillissement.
Des méthodes de métrologie du vieillissement se basant sur la longueur des télomères ont été développée. Aujourd’hui, on en dénombre 5 principales, dont TAT ou STELA. Elles permettent toutes, à partir de la longueur des télomères, de fournir des indications précieuses sur l’avancement de l’âge physiologique ainsi que sur le vieillissement.
Partie 5 : Télomères, vieillissement et thérapies
 La longueur des télomères constitue une piste intéressante pour élaborer des thérapies afin de lutter contre le vieillissement. On peut citer l’exemple d’Elizabeth Parrish, PDG de Bioviva ; elle a testé sur elle-même une thérapie génique développée par son propre laboratoire, thérapie qui vise à rallonger de ses télomères afin de « rajeunir » !
La longueur des télomères constitue une piste intéressante pour élaborer des thérapies afin de lutter contre le vieillissement. On peut citer l’exemple d’Elizabeth Parrish, PDG de Bioviva ; elle a testé sur elle-même une thérapie génique développée par son propre laboratoire, thérapie qui vise à rallonger de ses télomères afin de « rajeunir » !
Katidja Allaoui

Author
Auteure
Katidja studied biology and health engineering at the school of engineering of Angers.
More about the Long Long Life team
Katidja a étudié l’ingénierie de la biologie et de la santé à l’école d’ingénieurs de l’université d’Angers.
En savoir plus sur l’équipe de Long Long Life
Dr Guilhem Velvé Casquillas

Author/Reviewer
Auteur/Relecteur
Physics PhD, CEO NBIC Valley, CEO Long Long Life, CEO Elvesys Microfluidic Innovation Center
More about the Long Long Life team
Docteur en physique, CEO NBIC Valley, CEO Long Long Life, CEO Elvesys Microfluidic Innovation Center
En savoir plus sur l’équipe de Long Long Life
Sources :
[1] Chatterjee, S. (2017). Telomeres in health and disease. Journal of Oral and Maxillofacial Pathology, [online] 21(1), p.87. DOI : 10.4103/jomfp.JOMFP_39_16. [Accessed 22 May 2017].
[2] Blasco, M. (2007). Telomere length, stem cells and aging. Nature Chemical Biology, [online] 3(10), pp.640-649. DOI :10.1038/nchembio.2007.38 [Accessed 22 May 2017]
[3] Shay, J. (2016). Role of Telomeres and Telomerase in Aging and Cancer. Cancer Discovery, [online] 6(6), pp.584-593. DOI : 10.1016/j.semcancer.2011.10.001 [Accessed 22 May 2017].