Piwi-piRNA : une voie biologique d’immortalité
De nombreuses études semblent confirmer qu’une voie de régulation des gènes, la voie Piwi-piRNA, présente des propriétés de lutte contre le vieillissement que l’on peut retrouver dans la majorité des systèmes biologiques. Potentiellement, il existerait alors une voie biologique d’immortalité.
Lutter contre le vieillissement avec la voie Piwi-piRNA
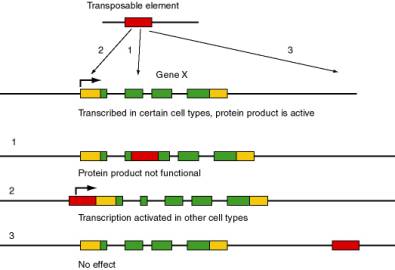
La principale fonction de cette voie de signalisation est d’inhiber l’activité des transposons, des éléments génétiques mobiles. Ces transposons sont des séquences d’ADN capables de se déplacer d’un locus génomique à un autre, causant ainsi des mutations spontanées. Il a été observé que chez les organismes âgés, ces transposons deviennent de plus en plus actifs [1] et de ce fait la quantité de mutations dans le génome des cellules somatiques augmente. Cette caractéristique des transposons souligne leur rôle décisif dans la mutagénèse et la dégradation progressive de l’information génétique. Or l’instabilité génomique est un facteur qui entre en compte lors du vieillissement. Ainsi, se pourrait-il que ces transposons soient des « marqueurs » moléculaires du vieillissement ?
Une étude récente, « The Piwi-piRNA pathway : road to immortality », a alors étudié cette hypothèse et démontré que ces instabilités génomiques, induites par les transposons, contribuent au processus du vieillissement et pourraient être inhibées par la voie Piwi-piRNA [2]. Il s’agit alors d’une découverte qui permettrait de mieux comprendre les mécanismes du vieillissement qui demeurent, pour les biologistes, un mystère aussi complexe que fascinant.
Sur quels mécanismes biologiques agit la voie Piwi-piRNA ?
L’instabilité génomique, entraînée par l’apparition de mutation non réparables dans l’ADN, est un élément fondamental du vieillissement cellulaire [2]. Néanmoins, il existerait des types cellulaires qui ne subiraient pas les effets du vieillissement. Une équipe a défini dans cette étude le principe de « cellules résistantes au vieillissement ». Il s’agirait de cellules ne subissant pas les effets du vieillissement et qui constituent un tissu pouvant créer une lignée « immortelle ». Dans ces cellules résistantes au vieillissement, l’intégrité du génome semble être préservée tout au long de la durée de vie. De ce fait, le tissu lui-même ne subit pas les effets du vieillissement, il ne se détériore alors pas au fil du temps et en l’absence d’instabilités génomique, il conserve ses capacités de prolifération et de survie [2].
Un mécanisme biologique semble être à l’origine de ce phénomène : la voie Piwi-piRNA (“P-element-induced wimpy testis in drosophila” – Piwi-interacting noncoding RNA). Il s’agit d’une voie de régulation des gènes, où des ARN non codants, les ARNpi, interagissent avec les protéines Piwi. A l’origine, ces protéines sont connues pour réprimer la différentiation des cellules souches et maintenir la stabilité génomique de la lignée germinale. Cette “machinerie moléculaire” semble être à l’origine des processus de maintien de l’intégrité du matériel génétique [2]. En effet, elle opère de façon prédominante dans les cellules résistantes au vieillissement, en ayant pour fonction de réprimer l’activité des éléments génétiques mobiles, les transposons.
Elle est connue pour être active dans les cellules germinales ainsi que dans les phases primaires de développement de l’embryon. Cette étude démontre également qu’en dehors de la lignée germinale, la voie Piwi-piRNA est active dans tous les types de cellules somatiques ne subissant pas les effets du vieillissement. On retrouve ce type de cellules chez différents organismes : chez les cellules souches somatiques des spongiaires (“éponges”), des méduses, des planaria, les limaces de mer, des drosophiles et chez certains mammifères [2].
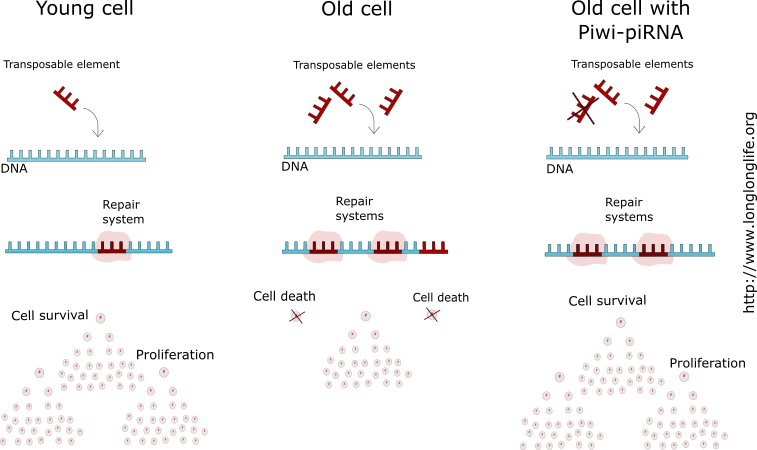
Le rôle joué par la voie Piwi-piRNA au cours du vieillissement
Dans les cellules somatiques “âgées”, la voie Piwi-piRNA est en grande partie inactive. Au cours du temps, en l’absence des composants permettant le bon fonctionnement de cette voie, il y a une perte progressive de l’hétérochromatine. Or, en temps normal, l’une des fonctions de l’hétérochromatine est d’inhiber la transcription des transposons [2].
Ainsi, à l’âge adulte, il y a augmentation de la mobilité des transposons, ce qui accentue le risque de générer des niveaux importants de dommages moléculaires, qui pourraient eux même empêcher les systèmes de réparation de l’ADN d’assurer le maintien cellulaire. En effet, il a démontré qu’en fonction de leur emplacement, les transposons peuvent induire l’inactivation de gènes indispensables au fonctionnement des systèmes de réparation et de maintenance. Ainsi, durant la vie adulte, ils contribuent à l’accumulation de dysfonctionnement cellulaire. Ne pouvant plus être réparées, ces cellules affectées demeurent alors endommagées puis sont éliminées via les mécanismes de mort cellulaire, afin d’assurer l’intégrité des tissus. Cependant, l’augmentation du taux de cellules mortes entraîne une détérioration des tissus, associée à des pathologies liées au vieillissement, jusqu’à potentiellement, la mort de l’organisme. Les transposons jouent alors un rôle central dans les processus de vieillissement.

En intervenant sur l’activité des transposons, la voie Piwi-piRNA semble également avoir un impact sur la durée de vie des cellules. En effet, cette étude démontre que cette voie protège les cellules germinales et les cellules somatiques résistantes au vieillissement de la mutagénèse médiée par les transposons [2]. Grâce à ses mécanismes de fonctionnement, seules les mutations occasionnelles générées par des mutagènes physiques ou chimiques surviennent et sont éliminées par les mécanismes cellulaires de maintien et de réparation.
Ainsi, ces cellules disposent d’un génome qui reste en grande partie intact et stable et de ce fait, ne subissent pas les effets du vieillissement. En d’autres termes, la voie Piwi-piRNA pourrait jouer un rôle critique dans l’immortalité cellulaire, et les transposons pourraient représenter les déterminant génétiques primaires du vieillissement [2].
Katidja Allaoui

Author
Auteure
Katidja studied biology and health engineering at the school of engineering of Angers.
More about the Long Long Life team
Katidja a étudié l’ingénierie de la biologie et de la santé à l’école d’ingénieurs de l’université d’Angers.
En savoir plus sur l’équipe de Long Long Life
Sources :
[1] Li, W., Prazak, L., Chatterjee, N., Grüninger, S., Krug, L., Theodorou, D., & Dubnau, J. (2013). Activation of transposable elements during aging and neuronal decline in Drosophila. Nature neuroscience, 16(5), 529-531.
[2] Sturm, Á., Perczel, A., Ivics, Z., & Vellai, T. (2017). The Piwi‐piRNA pathway: road to immortality. Aging Cell.
[3] Clarke, M. F., & Fuller, M. (2006). Stem cells and cancer: two faces of eve. Cell, 124(6), 1111-1115.