Les altérations épigénétiques comme causes du vieillissement
Le vieillissement peut se définir comme étant l’ensemble des phénomènes qui marquent l’évolution d’un organisme vivant vers la mort [1]. Ceux-ci entraînent la perte progressive de l’intégrité physiologique, ce qui, à terme, finit par altérer les fonctions biologiques [2]. Au cours du temps, le vieillissement s’exprime par l’apparition de maladies caractéristiques telles que le cancer, le diabète de type 2, les troubles cardiovasculaires et les maladies neurodégénératives. Aujourd’hui, il est admis que les phénomènes biologiques responsables du vieillissement regroupent au moins neuf processus moléculaires et cellulaires (voir l’article : comprendre les causes biologiques du vieillissement et de la longévité). Ces causes du vieillissement font l’objet de nombreuses publications scientifiques dont l’excellent article “The Hallmarks of Aging” [2], et le nombre de projets de recherche sur ces mécanismes ne cesse d’augmenter.
Tous ces phénomènes biologiques méritent qu’on s’y intéresse plus profondément pour comprendre leur complexité. Comme nous l’avons fait précédemment en consacrant un dossier au raccourcissement des télomères, cet article va porter spécifiquement sur les altérations épigénétiques en tant que causes du vieillissement. Il s’agit d’un processus complexe, car il regroupe de nombreux mécanismes biologiques qui, en chœur, vont affecter le modèle normal des processus épigénétiques.
Comprendre la génomique pour comprendre les altérations épigénétiques dues au vieillissement
Pour comprendre le concept d’épigénétique, il faut tout d’abord comprendre sur quoi cela agit : le génome. Notre information génétique est portée par l’ADN. C’est un code à quatre lettres, A, T, G et C, aussi appelé les nucléotides, ou bases, et dont l’enchaînement forme une séquence (un gène est une partie de séquence). L’ADN interagit avec une multitude d’éléments biologiques, entre autres pour le transcrire. Lors de la transcription, la séquence d’ADN est copiée pour former de l’ARN. Ensuite, l’ARN est lu et “traduit” en protéines, c’est l’étape de traduction. Ainsi, quand un gène est transcrit, puis traduit, on dit qu’il est exprimé.
Le génome humain comporte plus de 3 milliards de paires de bases. Une telle quantité de nucléotides mis bout-à-bout entraîne une longueur de séquence bien trop grande pour entrer dans le noyau cellulaire. Pour contrer ce problème, l’ADN est associé à des protéines, notamment les histones autour desquelles l’ADN s’enroule pour former ce qu’on appelle un nucléosome. Ainsi, l’ADN est compacté sous forme de chromatine et peut être contenu dans le noyau cellulaire. Il existe deux formes de chromatine : une forme très condensée qu’on appelle l’hétérochromatine et une forme peu condensée appelée l’euchromatine. Cette dernière est accessible à toute la machinerie transcriptionnelle, c’est donc sous cette forme que l’expression des gènes pourra se faire.
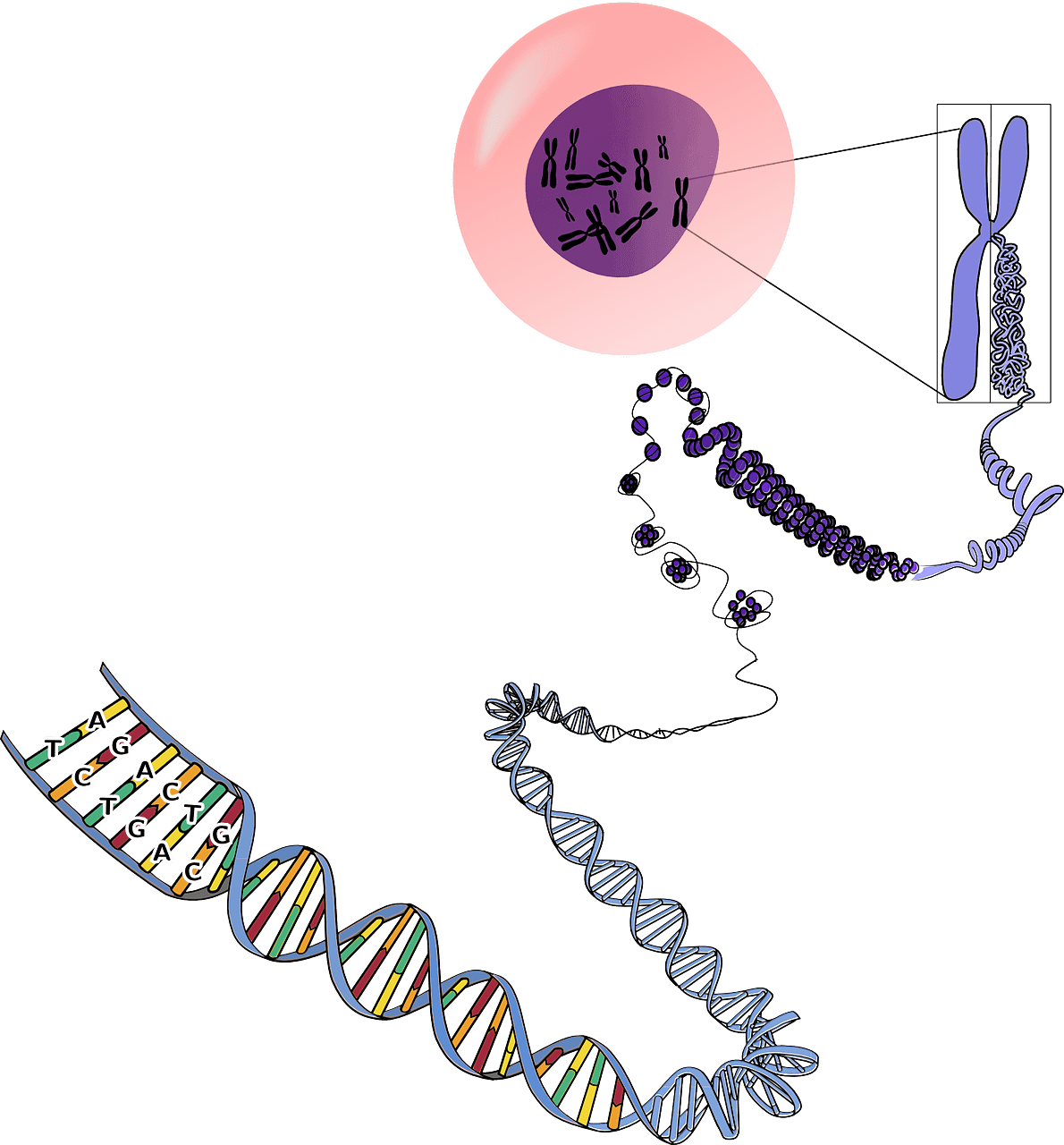
Et l’épigénétique dans tout ça ?
L’épigénétique, c’est l’étude des mécanismes qui vont modifier l’état de la chromatine, permettant ainsi de moduler l’expression des gènes sans changer la séquence. Ces mécanismes regroupent la méthylation de l’ADN, les modifications d’histones, le remodelage de la chromatine et les altérations transcriptionnelles de certains ARN spécifiques.
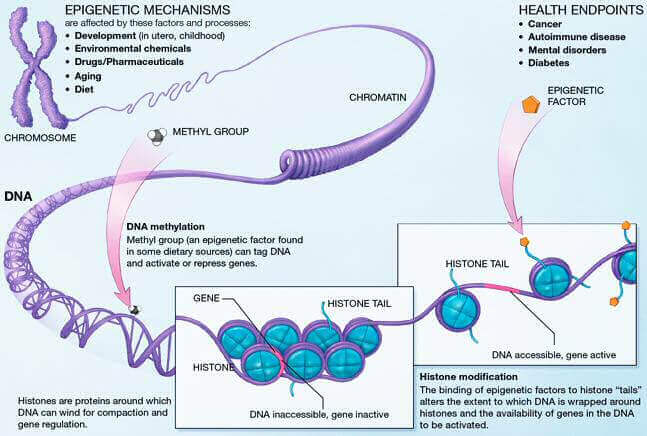
La méthylation de l’ADN et les altérations épigénétiques dues au vieillissement
Les niveaux de méthylation varient tout au long de la vie, mais avec l’âge, il ont une tendance globale à diminuer. La méthylation est un phénomène lors duquel un groupement chimique méthyle (-CH3) est ajouté à une base cytosine (C) de l’ADN. Elle entraîne la condensation de l’ADN, forme sous laquelle les gènes ne sont pas transcrits.
La modulation génique est un processus essentiel pour le maintien de l’équilibre cellulaire. En effet, toutes les cellules du corps portent le même génome, mais elles n’ont pas toutes la même finalité. De ce fait, une cellule du foie ne synthétise pas les mêmes protéines qu’une cellule de la peau. L’expression de certains gènes doit donc être activée ou réprimée, en fonction du destin de la cellule. Les modifications de méthylation liées à l’âge se font soit aléatoirement sur certaines cytosines (“Epigenetic drift”), soit sur des régions spécifiques de l’ADN où les changements de méthylation sont associés à l’âge. Ces derniers permettent de mesurer le vieillissement.
La méthylation de l’ADN à la base du principe d’horloge épigénétique
La méthylation de l’ADN est utilisée depuis quelques années comme un outil fiable de mesure pour estimer l’âge biologique. Ce phénomène, appelé l’horloge épigénétique, se base sur des sites CpG (portion d’ADN de deux bases dont la première est une cytosine et la deuxième une guanine et reliées entre elles par une liaison phosphate) associés à l’âge et dont le profil de méthylation peut être utilisé comme un indicateur précis de l’âge biologique [6].

La différence entre l’âge prédit par l’horloge épigénétique (notre âge biologique) et l’âge chronologique s’appelle l’accélération du vieillissement et peut être associée à un risque augmenté de maladies ou de mortalité. En d’autres termes, si l’âge biologique est supérieur à l’âge chronologique, le risque de développer des maladies liées à l’âge sera plus élevé. Il a été montré que l’accélération du vieillissement est associée à un risque élevé de cancer et à la baisse du taux de survie pendant et après la chimiothérapie [7], ainsi qu’à l’augmentation du risque de mortalité lié aux maladies cardiovasculaires [8].
Altérations épigénétiques par modification des histones
Au cours du vieillissement, les histones subissent, tout comme l’ADN, des changements épigénétiques. Les histones constituent les nucléosomes, des complexes protéiques autour desquels l’ADN s’enroule, permettant de condenser ou décondenser la chromatine. Les modifications qui les affectent sont principalement des méthylations et des acétylations (ajout d’un groupement chimique acétyle -COCH3). Des aberrations de méthylation entraîneraient une augmentation des récidives de cancer et un faible taux de survie. Avec l’âge, les changements de méthylation sont accompagnés par une perte globale du niveau d’acétylation de certaines histones (processus appelé hypoacétylation). Des études menées chez la souris ont montré qu’empêcher l’hypoacétylation liée à l’âge permettait de prévenir les troubles cognitifs et de réduire la sévérité de pathologies telles que la maladie de Parkinson, l’ostéoporose et les AVC [9,10].
Altérations épigénétiques par remodelage chromatinien
Pour maintenir l’architecture chromatinienne, des protéines chromosomales comme HP1α et des facteurs de remodelage chromatinien tels que les protéines Polycomb et le complexe NuRD sont indispensables. Avec l’âge, le niveau de ces protéines baisse et induit une perte globale d’hétérochromatine, établie comme étant une marque de vieillissement [2]. Un tel phénomène se retrouve chez les personnes atteintes des syndromes de vieillissement prématuré, comme la maladie de Werner et la maladie de Huntchinson-Gilford [11].
Altérations épigénétiques par modification transcriptionnelle
On entend par altérations transcriptionnelles toutes les modifications concernant les niveaux d’ARN non-codants. Ce sont des outils prometteurs pour le développement de nouveaux biomarqueurs de diagnostic ou de pronostic, mais aussi pour le développement de nouvelles cibles thérapeutiques. Comme leur nom l’indique, ce sont des ARN qui ne sont pas traduits en protéines, mais ils sont d’importants régulateurs de la transcription et de l’architecture chromatinienne. Parmi ces ARN, on retrouve des ARN non-codant courts et des ARN non-codant longs (lncRNA). Ces ARN sont transcrits de façon aberrante dans les cancers et les maladies cardiovasculaires, entre autres.
Réversibilité des altérations épigénétiques dues au vieillissement
Contrairement aux mutations sur l’ADN, les altérations épigénétiques sont réversibles. En effet, les changements épigénétiques sont introduits par des enzymes et leurs actions sont modulables. De plus, les voies de signalisation régulant ces enzymes peuvent être ciblées par des médicaments. Enfin, des changements du comportement et du mode de vie peuvent aussi modifier les altérations épigénétiques.
L’ “epigenome editing”
Cette technique permet de modifier les états épigénétiques de la chromatine de la manière suivante : des facteurs se lient à des sites spécifiques de l’ADN pour induire ou supprimer des altérations épigénétiques. Récemment, la technologie d’ « epigenome editing » basée sur CRISPR-Cas9 a permis de cibler différents sites génomiques pour inverser les altérations épigénétiques [12]. La technologie d’ “epigenome editing” permet d’agrandir les possibilités de recherche et pourrait conduire au développement de nouvelles cibles thérapeutiques et de traitements. Elle reste néanmoins incertaine sur certains points : les résultats obtenus peuvent être limités car d’autres causes entrent en jeu dans le développement de maladies.
Définitions :
Epigénétique : l’étude des mécanismes de modification de la chromatine permettant de moduler l’expression des gènes sans changer la séquence nucléotidique de l’ADN.
Histone : les protéines constitutives du nucléosome, complexe protéique autour duquel s’enroule la chromatine permettant de la condenser ou la décondenser.
Dinucléotide CpG : un site CpG est une portion d’ADN de deux bases dont la première est une cytosine et la deuxième une guanine et qui sont reliées entre elles par une liaison phosphate.
Homéostasie : c’est un état dans lequel les fonctions sont correctement assurées menant à la bonne organisation d’un système.
Âge chronologique : il s’agit de l’âge donné par la date de naissance, à ne pas confondre avec l’âge biologique qui est celui donné à vos cellules et basé sur le fonctionnement des différentes activités cellulaires.
Protéine chromosomale : protéine interagissant avec l’ADN et régulant la condensation de la chromatine. Leur action permet de condenser la chromatine et diffère de celle des histones qui est aussi mécanique.
Facteur de remodelage chromatinien : ce sont des complexes protéiques qui modifient la structure du nucléosome pour modifier l’état de condensation de la chromatine.
Biomarqueur : c’est une caractéristique mesurable qui permet de détecter un processus biologique normal ou pathologique.
Tout notre dossier sur l’épigénétique du vieillissement et la longévité :
Les altérations épigénétiques comme causes du vieillissement
Comprendre les altérations épigénétiques qui entraînent le vieillissement : récapitulatif des mécanismes impliqués.
Partie 2 : Épigénétique et ARNs non codants : le rôle des microARN et LncARN sur la longévité
La totalité de l’ADN ne code pas forcément des protéines ; les ARN non-codants tels que les microARN jouent aussi un rôle dans le processus de vieillissement.
Partie 4 : Epigenome editing, une technologie anti-vieillissement et pro-longévité
 Avec la naissance de l’épigénétique, une nouvelle technologie a vu le jour : l’epigenome editing, grâce à des avancées telles que l’outil CRISPR-Cas9.
Avec la naissance de l’épigénétique, une nouvelle technologie a vu le jour : l’epigenome editing, grâce à des avancées telles que l’outil CRISPR-Cas9.
Partie 1 : Les mécanismes moléculaires des altérations épigénétiques dans le vieillissement
Qu’est-ce que l’épigénétique ? Comment les altérations moléculaires entraînant le vieillissement en arrivent-elles à se produire ?
Partie 3 : L’horloge épigénétique, puissant outil de mesure du vieillissement
 On peut utiliser l’épigénétique comme un outil de mesure du vieillissement, en cartographiant les modifications qui surviennent avec l’âge.
On peut utiliser l’épigénétique comme un outil de mesure du vieillissement, en cartographiant les modifications qui surviennent avec l’âge.
Références:
[1] http://www.larousse.fr/dictionnaires/francais/vieillissement/81927
[2] Carlos Lopez-Otin, Maria A. Blasco, Linda Partridge, Manuel Serrano and Guido Kroemer. The Hallmarks of Aging, Cell 153, June 2013, 1194-1217.
[3] Neelam Goel, Priya Karir, Vivek Kumar Garg. Role of DNA methylation in human age prediction, Mechanisms of Ageing and Development 166 (2017) 33-41.
[4] Bérénice A. Benayoun, Elizabeth A. Pollina and Anne Brunet. Epigenetic regulation of ageing: linking environmental inputs to genomic stability, Nature Reviews, Molecular Cell Biology, volume 16 (October 2015), 593-610.
[5] Ciccarone, F., Mechanisms of Ageing and Development (2017), https://doi.org/10.1016/j.mad.2017.12.002
[6] Declerck, K., Mechanisms of Ageing and Development (2018), https://doi.org/10.1016/j.mad.2018.01.002
[7] Pierre-Antoine Dugué, Julie K. Bassett, JiHoon E. Joo, Chol-Hee Jung, Ee Ming Wong, Margarita Moreno-Betancur, Daniel Schmidt, Enes Makalic, Shuai Li, Gianluca Severi, Allison M. Hodge, Daniel D. Buchanan, Dallas R. English, John L. Hopper, Melissa C. Southey, Graham G. Giles and Roger L. Milne. DNA methylation-based biological aging and cancer risk and survival: Pooled analysis of seven prospective studies. Int. J. Cancer: 00, 00–00 (2017).
[8] Laura Perna, Yan Zhang, Ute Mons, Bernd Holleczek, Kai-Uwe Saum and Hermann Brenner. Epigenetic age acceleration predicts cancer, cardiovascular, and all-cause mortality in a German case cohort, Clinical Epigenetics (2016) 8:64.
[9] Nard Kubben and Tom Misteli. Shared molecular and cellular mechanisms of premature ageing and ageing-associated diseases, Nature Reviews, Molecular Cell Biology, Volume 18 (October 2017), 595-609.
[10] Ibraheem Ali, Ryan J. Conrad, Eric Verdin and Melanie Ott. Lysine Acetylation Goes Global: From Epigenetics to Metabolism and Therapeutics, Chem. Rev. 2018, 118, 1216−1252.
[11] Lauren N. Booth and Anne Brunet. The Aging Epigenome, Mol Cell. 2016 June 2; 62(5): 728–744. doi:10.1016/j.molcel.2016.05.013.
[12] Cia-Hin Lau and Yousin Suh. Genome and Epigenome Editing in Mechanistic Studies of Human Aging and Aging-Related Disease, Gerontology. 2017 ; 63(2): 103–117. doi:10.1159/000452972.
Anne Fischer

Author
Auteur
Anne is studying medicine science at the Institute of Pharmaceutical and Biological Science in Lyon and she has graduated with a Bachelor’s degree in molecular and cellular biology at the University of Strasbourg.
More about the Long Long Life team
Anne étudie les sciences du médicament à l’Institut des Sciences Pharmaceutiques et Biologiques de Lyon. Elle est titulaire d’une licence en biologie moléculaire et cellulaire de l’Université de Strasbourg.
En savoir plus sur l’équipe de Long Long Life
Dr Guilhem Velvé Casquillas

Author/Reviewer
Auteur/Relecteur
Physics PhD, CEO NBIC Valley, CEO Long Long Life, CEO Elvesys Microfluidic Innovation Center
More about the Long Long Life team
Docteur en physique, CEO NBIC Valley, CEO Long Long Life, CEO Elvesys Microfluidic Innovation Center
En savoir plus sur l’équipe de Long Long Life