Le métabolisme: un mécanisme fondamental, mais fragile

Pour comprendre les maladies métaboliques, il est nécessaire de savoir ce que l’on définit par métabolisme. Le métabolisme, au sens large, regroupe l’intégralité des réactions chimiques ayant lieu dans notre organisme. Il est subdivisé en deux parties: l’anabolisme et le catabolisme.
L’anabolisme correspond aux réactions chimiques de notre corps aboutissant à la fabrication de nouvelles molécules fonctionnelles. La synthèse de nouvelles protéines ou la réplication de l’ADN en font partie. À l’inverse, le catabolisme correspond aux réactions de dégradation. On y retrouve par exemple la dégradation des sucres et des graisses pour en faire de l’énergie. Le recyclage des protéines endommagées rentre aussi dans cette catégorie.
De plus, pour que notre corps fonctionne correctement, il est important que ces deux phénomènes soient en équilibre. Voici un exemple simple pour l’illustrer. Prenons une cellule qui synthétiserait plus vite ses protéines qu’elle ne peut les recycler. On pourrait alors imaginer qu’au début, tout se passe bien. Hélas, au bout d’un certain temps, les protéines s’abîment. Elles deviennent donc moins performantes voire dangereuses pour la cellule. De plus, la cellule les recycle trop lentement. Elle ne peut donc pas récupérer d’acides aminés, les blocs de construction des protéines. Elle devient donc incapable de synthétiser de nouvelles protéines fonctionnelles : les vieilles protéines s’accumulent et la cellule meurt.
Les maladies que nous allons décrire dans cet article ont toutes pour cause un dérèglement de cet équilibre production/dégradation suite au vieillissement. Nous verrons ensemble trois exemples parmi les plus récurrents, pouvant impacter n’importe quelle partie de notre organisme.
Métabolisme et vieillissement: diabète, le métabolisme ne trouve plus son carburant
La première maladie métabolique liée au vieillissement que nous allons traiter est le diabète. Il en existe trois types. On distingue le diabète de type I, de type II et enfin le diabète gestationnel. Le diabète que l’on déclare en vieillissant est généralement le diabète de type II [1], mais nous allons y revenir.
Métabolisme et vieillissement: l’insuline, aiguilleur du métabolisme
Tout d’abord, qu’est-ce que le diabète? Pour le comprendre, il faut d’abord s’intéresser au mécanisme qu’utilise le corps pour faire parvenir le glucose, principal carburant des cellules, à tous nos organes. Lorsque l’on mange, notre taux de glucose sanguin augmente. Néanmoins, pour qu’une cellule l’absorbe, elle doit recevoir un signal hormonal: l’insuline. Cette hormone est sécrétée par des cellules très spécifiques de notre pancréas, les cellules β. Ces cellules sont capables de sentir d’une manière très précise le taux de glucose sanguin. Lorsque celui-ci s’élève, elles sécrètent de l’insuline et nos cellules peuvent absorber le sucre jusqu’à ce que son taux redescende. L’insuline stimule également la plupart des activités anaboliques, mentionnées en introduction, de notre organisme, indiquant de cette manière à nos cellules que l’énergie nécessaire est disponible [2]. Ainsi, l’insuline agit comme organisateur d’une grande partie de notre métabolisme. Lorsque l’insuline n’assume plus sa fonction, notre corps dysfonctionne: c’est le diabète.

Métabolisme et vieillissement: la fonction de l’insuline altérée par le vieillissement
Le vieillissement est l’un des principaux facteurs qui va dégrader ce système indispensable à la gestion de l’énergie par notre corps [3]. Pour qu’un signal n’assure plus sa fonction, il peut y avoir deux raisons: il n’est pas envoyé ou n’est pas reçu. Le même phénomène s’applique pour le signal de l’insuline. Les deux causes principales du diabète témoignent d’un problème d’envoi ou de réception de l’hormone. Il s’agit donc de l’envoi de l’insuline par nos cellules β ou de l’aptitude de nos organes à interpréter le signal [4].

Métabolisme et vieillissement : Des cellules β dépassées
Traitons tout d’abord des problèmes d’envoi, touchant donc les cellules β. Dans le cas du diabète de type I, elles sont intégralement détruites par le système immunitaire [5]. C’est la forme du diabète dite « héréditaire » car elle se déclenche le plus souvent chez les personnes jeunes et dure toute la vie. Ce phénomène peut également être observé lors du vieillissement. Dans le cas du diabète de type II touchant les personnes âgées, le nombre de cellule β est souvent impacté, mais dans une moindre mesure (30 à 40% de moins que chez les individus sains). Les raisons identifiées sont également différentes, il s’agirait d’une prédisposition de ces cellules à mourir rapidement [6] ou une incapacité à pratiquer l’autophagie [7]. Ce phénomène s’accompagne également d’une incapacité des cellules β des malades à sécréter suffisamment d’insuline quand le taux de glucose monte [8]. Ainsi, étant moins nombreuses et moins performantes, les cellules β des malades n’arrivent plus à assurer leur fonction et les signaux de l’insuline ne suffisent plus.
Métabolisme et vieillissement : des organes rendus insensibles
Le second phénomène rendant les signaux de l’insuline défectueux est l’arrêt de leur réception par notre corps. Ce phénomène peut être lié à une dysfonction des récepteurs à l’insuline, de petites protéines permettant sa fixation à la surface des cellules [9]. Parfois, ce récepteur est même systématiquement détruit [10].
Il peut y avoir une seconde raison à la mauvaise réception des signaux insuliniques par notre corps, et il est beaucoup moins direct que la simple dysfonction du récepteur. La voie de signalisation de l’insuline est un phénomène complexe à l’intérieur même de la cellule, faisant intervenir de nombreuses protéines [11]. Or, ces protéines peuvent être déjà occupées ailleurs, ou absentes. Ainsi, de nombreux phénomènes souvent associés à l’âge comme la dysfonction des mitochondries [12], l’inflammation [13] ou la réponse au mauvais repliement des protéines [14] utilisent les protéines dont l’insuline a besoin pour faire passer son message, les rendant inaccessibles. En combinant ces deux causes, les cellules de patients diabétiques deviennent insensibles à l’insuline, qui ne peut donc plus assumer son rôle.

En résumé, le vieillissement peut donc provoquer l’apparition du diabète en empêchant notre corps d’absorber correctement le glucose qu’il possède. Ce phénomène est dû à un dérèglement de la communication du pancréas avec le reste du corps via l’insuline.
Métabolisme et vieillissement: diabète, conséquences et traitements
Comme on peut l’imaginer, les conséquences d’une incapacité à faire parvenir correctement le glucose dans nos cellules sont importantes sur le métabolisme, et donc sur la santé des malades. Le diabète provoque par exemple une fatigue importante, une perte de poids malgré une alimentation suffisante, des troubles de la vision, une vulnérabilité face aux infections [15] … Heureusement, il existe de nombreux traitements. Le plus commun consiste en l’injection d’insuline, permettant de remplacer les cellules β disparues ou moins performantes. Ceci permet aussi aux cellules d’obtenir un taux d’insuline suffisamment haut malgré leur incapacité à le sentir correctement [16]. De plus, un mode de vie plus sain ou la prise de certaines molécules lorsque le diabète se déclare l’empêchent de progresser [4]. Enfin, de nombreuses pistes prometteuses existent, soit pour restaurer le nombre de cellules β [17] soit pour rendre le corps plus sensible à l’insuline [18]. Ceci pourrait permettre, dans le futur, d’éradiquer cette maladie perturbant notre métabolisme.
Métabolisme et vieillissement : la goutte, quand les déchets du métabolisme s’accumulent

Comme nous l’avons défini précédemment, le métabolisme est un ensemble de procédés de production et de dégradation. Hélas, tout ce qu’il produit n’est pas infiniment recyclable. Tout comme les systèmes de production humains, le métabolisme crée des déchets. La comparaison ne s’arrête pas là. En effet, s’ils s’accumulent, ces déchets peuvent devenir hautement toxiques. Comme nous allons le voir, la goutte résulte d’une mauvaise gestion des déchets du métabolisme. Leur accumulation à proximité des articulations de notre corps va alors intoxiquer les cellules qui s’y trouvent, tout comme une décharge à ciel ouvert intoxiquerait l’environnement alentours.
Métabolisme et vieillissement : l’acide urique, un déchet toxique du métabolisme
L’ADN, support de notre information génétique, est indispensable à notre organisme. Néanmoins, il est parfois nécessaire de le dégrader. Là, les choses se compliquent. En effet, une partie de ses constituants, les purines pour être plus précis, ne sont pas totalement dégradables. Chez l’humain et les grands primates, leur dégradation aboutit à la formation d’une molécule potentiellement toxique: l’acide urique [19].
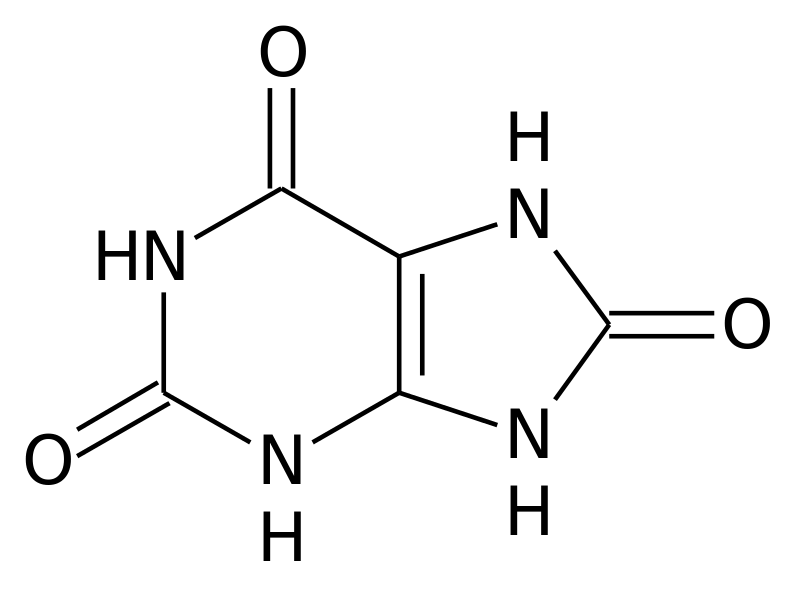
Mais comment et pourquoi s’accumule-t-il? Pour qu’un déchet s’accumule, il existe deux moyens: soit le déchet est trop produit, soit on ne s’en débarrasse pas assez vite. Dans le cas des patients atteints de goutte, l’accumulation est dans la majorité des cas due à un problème d’excrétion de l’acide urique [20]. Normalement, notre corps se débarrasse de l’acide urique par les reins (donc via l’urine) ou par les intestins [21]. Hélas, en vieillissant, ces procédés peuvent être dérégulés [22]. Ceci entraîne une accumulation de l’acide urique dans le sang, qui devient alors capable de former des cristaux [23]. Ce sont ces cristaux qui sont toxiques pour nos cellules et qui vont provoquer l’apparition de la goutte.

Métabolisme et vieillissement : un poison pour nos articulations
En s’accumulant au niveau des articulations, les cristaux provoquent d’impressionnantes inflammations. Mais pourquoi? Nos cellules sont capables, afin d’étudier leur environnement, d’absorber une partie de ce qui les entoure pour l’examiner. Dans le cas de la goutte, c’est ce qui va provoquer leur perte! En effet, les cellules ayant absorbé des cristaux se retrouvent empoisonnées. De plus, celles-ci s’enflamment et développent un complexe moléculaire appelé inflammasome. Ce complexe moléculaire agit comme une usine de production de signaux d’appel à l’aide pour le système immunitaire. Le système immunitaire, lorsqu’il arrive sur l’articulation touchée, va alors entreprendre de la nettoyer. Hélas, c’est un procédé loin d’être délicat et l’articulation s’en trouve durablement abîmée: c’est la goutte [24].
De l’extérieur, celle-ci prend la forme d’un fort gonflement de l’articulation, d’une élévation de sa température et d’une perte progressive de sa mobilité. On parle alors d’arthrite aiguë, un phénomène très douloureux [25]. Ces inflammations arrivent par crises et ne sont pas permanentes. Néanmoins, si le phénomène persiste, des nodules, sortes de gonflements permanents mais non douloureux, peuvent se former ajoutant ainsi un handicap supplémentaire [26]. L’articulation la plus touchée est le gros doigt de pied, ce qui empêche le plus souvent les patients atteints de goutte de se déplacer normalement [27].
Cependant, ne paniquons pas tout de suite : la goutte se traite bien. Il existe de nombreux traitements permettant de réduire le taux d’acide urique dans le sang et, dans le pire des cas, les cristaux d’acide urique peuvent être retirés par chirurgie [24]. Ainsi, malgré l’inconfort manifeste qu’elle représente, la goutte est l’une des maladies métaboliques liées au vieillissement les moins redoutables.
Métabolisme et vieillissement: l’anémie, le métabolisme suffoque
Il ne vous est probablement pas inconnu que pour vivre, nous devons respirer du dioxygène. Et bien la raison en est métabolique! En effet, le dioxygène est indispensable à nos mitochondries, présentes dans chacune de nos cellules. Elles l’utilisent pour fabriquer de l’ATP, le carburant de notre métabolisme. Pour faire le lien avec la partie sur le diabète, le glucose est une des sources principales d’énergie servant à produire l’ATP. Si l’on compare l’ATP au carburant que nos cellules consomment, le glucose serait une forme de pétrole brut et les mitochondries la raffinerie. Mais voilà, sans dioxygène, la raffinerie de nos cellules tombe en panne.
Métabolisme et vieillissement: acheminer le dioxygène, tout un défi
Pour les êtres vivants composés que d’une ou de peu de cellules, se fournir en oxygène est facile. Celui-ci diffuse simplement du milieu extérieur vers l’intérieur des cellules. Mais pour les organismes comme nous, constitués de milliards de cellules ayant toutes besoin de dioxygène, les choses se compliquent. Dans notre cas, l’entrée de dioxygène ne se fait que par les poumons. Mais comment l’acheminer partout dans notre corps? C’est là l’un des principaux rôles de notre système circulatoire, qui fait voyager le sang dans notre organisme.
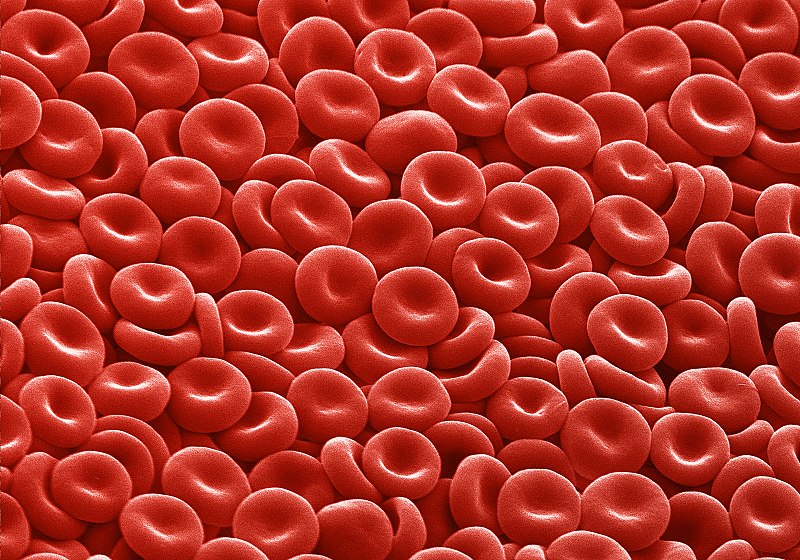
Le dioxygène y est transporté par des cellules, les hématies, que l’on appelle communément les globules rouges. Pour transporter l’oxygène, elles emploient une protéine, l’hémoglobine. Celle-ci agit comme véritable conteneur pour le dioxygène. Pas d’hémoglobine, pas de transport de dioxygène, pas de survie des cellules. Un détail pouvant paraître anodin mais ayant pourtant une grande importance: l’hémoglobine utilise du fer pour fixer le dioxygène, ce qui donne sa couleur rouge au sang.
Hélas, lorsque l’on vieillit, la quantité d’hémoglobine dans le sang peut diminuer: on parle alors d’anémie.
Métabolisme et vieillissement : Anémie et vieillissement: les causes d’une perte d’hémoglobine
Le phénomène d’anémie toucherait jusqu’à 11% des plus de 65 ans [28] et plus de 20% des plus de 85 ans [29]. Mais quelles en sont les causes? Pour diminuer la quantité d’hémoglobine, il existe deux moyens majoritaires: diminuer le nombre de cellules qui la transportent (les hématies) ou alors diminuer la quantité d’hémoglobine présente dans les cellules qui la transportent.
Métabolisme et vieillissement: le nombre d’hématies peut diminuer avec l’âge
Les hématies sont renouvelées par les cellules souches du sang: les cellules souches hématopoïétiques. Seulement, pour ce faire, ces cellules souches doivent recevoir une hormone, l’EPO. Celle-ci est fabriquée par les reins. Or, le vieillissement s’accompagne parfois d’insuffisance rénales, donc d’une perte de production d’EPO, entraînant finalement une diminution du nombre d’hématies [30]. Une autre raison expliquant la diminution des hématies est également un épuisement avec le temps du nombre de cellules souches, un épuisement dont les cellules souches hématopoïétiques ne sont pas exemptées [31].
Métabolisme et vieillissement: faute de fer, pas d’hémoglobine:
Comme nous l’avons expliqué précédemment, pour fixer le dioxygène et fonctionner, l’hémoglobine a besoin de fer. Hélas, le vieillissement s’accompagne parfois de troubles gastro-intestinaux impliquant un relâchement de sang dans le tube digestif. Le fer compris dans le sang est alors perdu. Ceci est une des causes principales des anémies dues à des carences en fer chez les personnes âgées [32]. Plus encore, les inflammations chroniques, plus fréquentes chez les personnes âgées, sont indirectement responsables d’un manque de fixation de fer par l’hémoglobine. En effet, en cas d’inflammation, le foie peut produire une molécule, l’hepicidine. Celle-ci empêche l’intestin d’absorber le fer et en parallèle encourage la recirculation de celui-ci dans l’organisme, empêchant l’hémoglobine de l’utiliser. On parle alors d’anémie inflammatoire [33].
Ainsi, de deux manières différentes, le vieillissement peut provoquer une baisse de la quantité d’hémoglobine dans le sang, et donc des problèmes de transport de l’oxygène. Mais quelles en sont les conséquences?
Métabolisme et vieillissement : conséquences de l’anémie sur le métabolisme, une maladie très handicapante
Comme on pourrait le deviner, l’anémie chez les personnes âgées est lourde de conséquences. Chez les patients de plus de 85 ans, elle multiplierait le taux de mortalité par 1,6 chez la femme et par près de 2,3 chez l’homme [34]. Chose que l’on peut comprendre lorsque notre métabolisme est impacté, l’anémie s’accompagne de trouble fonctionnels importants [35], cognitifs [36] et de risques accrus de chutes chez personnes âgées [37].
De plus, l’anémie en elle-même est parfois dure à traiter. En effet, la seule solution est de résoudre le problème l’ayant causé, ce qui peut parfois se révéler être compliqué. Ainsi, traiter un patient avec de l’EPO alors que celui-ci est en déficit de cellules souches hématopoïétiques serait inefficace. Autre exemple, transfuser un patient avec du sang chargé en hémoglobine serait inutile s’il souffre de saignements gastro-intestinaux [32].
Ainsi, les maladies liées au métabolisme peuvent prendre toutes sortes de formes. Comment se douter qu’une douleur articulaire comme la goutte puisse puiser ses origines dans une mauvaise utilisation de l’énergie de notre corps? Cependant, les récents progrès réalisés dans la recherche sur le métabolisme nous permettent peu à peu de cerner précisément les causes et le fonctionnement de ces maladies. C’est en les étudiant, en augmentant de plus en plus la précision de nos connaissances à leur sujet, que nous parviendrons demain à les contrer.
Les maladies du vieillissement : voir notre dossier
Références:
[1] Virally, M., Laloi-Michelin, M., Kevorkian, J. P., Bitu, J., & Guillausseau, P. J. (2011). Specificities of type 2 diabetes in the elderly. Sang Thrombose Vaisseaux, 23(8), 409-415.
[2] Wilcox G. Insulin and Insulin Resistance. Clinical Biochemist Reviews. 2005;26(2):19-39.
[3] Muller, D. C., Elahi, D., Tobin, J. D. & Andres, R. Insulin response during the oral glucose tolerance test: the role of age, sex, body fat and the pattern of fat distribution. Aging (Milano) 8, 13–21 (1996).
[4] DeFronzo, R. A., Ferrannini, E., Groop, L., Henry, R. R., Herman, W. H., Holst, J. J., … & Simonson, D. C. (2015). Type 2 diabetes mellitus. Nature reviews Disease primers, 1, 15019.
[5] Katsarou, A., Gudbjörnsdottir, S., Rawshani, A., Dabelea, D., Bonifacio, E., Anderson, B. J., … & Lernmark, Å. (2017). Type 1 diabetes mellitus. Nature reviews Disease primers, 3, 17016.
[6] Marchetti, P. et al. The endoplasmic reticulum in pancreatic beta cells of type 2 diabetes patients. Diabetologia 50, 2486–2494 (2007).
[7] Marchetti, P. & Masini, M. Autophagy and the pancreatic beta-cell in human type 2 diabetes. Autophagy 5, 1055–1056 (2009).
[8] Deng, S. et al. Structural and functional abnormalities in the islets isolated from type 2 diabetic subjects. Diabetes 53, 624–632 (2004)
[9] Copps, K. D. & White, M. F. Regulation of insulin sensitivity by serine/threonine phosphorylation of insulin receptor substrate proteins IRS1 and IRS2. Diabetologia 55, 2565–2582 (2012).
[10] Hiratani, K. et al. Roles of mTOR and JNK in serine phosphorylation, translocation, and degradation of IRS‑1. Biochem. Biophys. Res. Commun. 335, 836–842 (2005)
[11] Krüger, M. et al. Dissection of the insulin signaling pathway via quantitative phosphoproteomics. Proc. Natl Acad. Sci. USA 105, 2451–2456 (2008).
[12] Petersen, K. F. et al. Mitochondrial dysfunction in the elderly: possible role in insulin resistance. Science 300, 1140–1142 (2003).
[13] Romeo, G. R., Lee, J. & Shoelson, S. E. Metabolic syndrome, insulin resistance, and roles of inflammation — mechanisms and therapeutic targets. Arterioscler. Thromb. Vasc. Biol. 32, 1771–1776 (2012).
[14] Herschkovitz, A. et al. Common inhibitory serine sites phosphorylated by IRS‑1 kinases, triggered by insulin and inducers of insulin resistance. J. Biol. Chem. 282, 18018–18027 (2007).
[15] https://infos-diabete.com/diabete/diabete-de-type-2/
[16] DeFronzo, R. A. Banting lecture. From the triumvirate to the ominous octet: a new paradigm for the treatment of type 2 diabetes mellitus. Diabetes 58, 773–795 (2009).
[17] Vasavada, R. C. et al. Protein kinase C‑ζ activation markedly enhances β-cell proliferation: an essential role in growth factor mediated β-cell mitogenesis. Diabetes 56, 2732–2743 (2007).
[18] Gaich, G. et al. The effects of LY2405319, an FGF21 analog, in obese human subjects with type 2 diabetes. Cell Metab. 18, 333–340 (2013).
[19] Angstadt, Carol N. (4 December 1997). « Purine and Pyrimidine Metabolism: Purine Catabolism ». NetBiochem.
[20] Perez-Ruiz F, Calabozo M, Erauskin GG, Ruibal A, Herrero-Beites AM. Renal underexcretion of uric acid is present in patients with apparent high urinary uric acid output. Arthritis Rheum 2002; 47: 610–13.
[21] Mandal AK, Mount DB. The molecular physiology of uric acid homeostasis. Annu Rev Physiol 2015; 77: 323–45.
[22] Kuo C-F, Grainge MJ, Zhang W, Doherty M. Global epidemiology of gout: prevalence, incidence and risk factors. Nat Rev Rheumatol 2015; 11: 649–62.
[23] Loeb JN. The infl uence of temperature on the solubility of monosodium urate. Arthritis Rheum 1972; 15: 189–92.
[24] N. Dalbeth, T. R. Merriman, and L. K. Stamp, “Gout,” The Lancet, vol. 388, no. 10055, pp. 2039–2052, 2016.
[25] Taylor WJ, Fransen J, Jansen TL, et al. Study for Updated Gout Classification Criteria (SUGAR): identifi cation of features to classify gout. Arthritis Care Res (Hoboken) 2015; 67: 1304–15.
[26] Aati O, Taylor WJ, Siegert RJ, et al. Development of a patient-reported outcome measure of tophus burden: the tophus impact questionnaire (TIQ-20). Ann Rheum Dis 2015; 74: 2144–50.
[27] Grahame R, Scott JT. Clinical survey of 354 patients with gout. Ann Rheum Dis 1970; 29: 461–68
[28] Guralnik JM, Eisenstaedt RS, Ferrucci L, Klein HG, Woodman RC. Prevalence of anemia in persons 65 years and older in the United States : Evidence for a high rate of unexplained anemia. Blood 2004;104:2263-8.
[29] Patel KV. Epidemiology of anemia in older adults. Semin Hematol 2008;45:210-7.
[30] McClellan W, Aronoff SL, Bolton WK, et al. The prevalence of anemia in patients with chronic kidney disease. Curr Med Res Opin 2004;20:1501-10.
[31] Geiger H, Van Zant G. The aging of lympho-hematopoietic stem cells. Nat Immunol 2002;3:329-33.
[32] Emilia Frangos, Kaveh Samii, Jean-Jacques Perrenoud, Ulrich M. Vischer. L’anémie du sujet âgé : une pathologie fréquente à ne pas banaliser. Rev Med Suisse 2010; volume 6.2125–2129.
[33] Lasocki S, Baron G, Driss F, et al. Diagnostic accuracy of serum hepcidin for iron deficiency in critically ill patients with anemia. Intensive Care Med 2010;36: 1044-8.
[34] Izaks GJ, Westendorp RG, Knook DL. The definition of anemia in older persons. JAMA 1999;281:1714-7.
[35] Thein M, Ershler WB, Artz AS, et al. Diminished quality of life and physical function in community-dwelling elderly with anemia. Medicine (Baltimore) 2009;88: 107-14.
[36] Zamboni V, Cesari M, Zuccala G, et al. Anemia and cognitive performance in hospitalized older patients : Results from the GIFA study. Int J Geriatr Psychiatry 2006;21:529-34.
[37] Dharmarajan TS, Avula S, Norkus EP. Anemia increases risk for falls in hospitalized older adults : An evaluation of falls in 362 hospitalized, ambulatory, long-term care, and community patients. J Am Med Dir Assoc 2006;7:287-93.
Baptiste Tesson

Author
Auteur
Baptiste is studying biology at the École Normale Supérieure de Lyon and bioengineering at the École Polytechnique Fédérale de Lausanne. He worked on the optimization of Cas9 as a tool for genome editing and on the emergence of blood stem cells in the zebrafish. He currently works on the patterning of the muscles, also in the zebrafish. He plans on doing a PhD in developmental biology.
More about the Long Long Life team
Baptiste étudie la biologie à l’École Normale Supérieure de Lyon et la bioingénierie à l’École Polytechnique Fédérale de Lausanne. Il a travaillé sur l’optimisation de la protéine Cas9 comme outil de modification de génomes et sur le développement des cellules souches du sang chez le poisson zèbre et travaille actuellement sur la mise en place des muscles chez le même animal. Il projette de réaliser un doctorat axé vers le développement animal.
En savoir plus sur l’équipe de Long Long Life















